- 离子浓度大小的比较
- 共173题
我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理。
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应
有关物质的量随时间的变化如图所示。
(1)0~2 min内的平均反应速率
平衡常数表达式为
(2),相同温度下,若开始加入
A,平衡常数
B,
C,达到平衡的时间
D,平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的 ( )
A,充入少量氨气
B,降温至0℃
C,充入少量硫化氢
D,加压
(4)常温下,将
① 浓度为
② 
③ 
则a、b、c、d之间由大到小的关系是: 。
(5)常温下,取
表示醋酸溶液中pH变化曲线的是 (填“A”或“B”);设盐酸中加入的Zn质量为



(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是
A,在A、B间任一点,溶液中一定都有
B,在B点,
C,在C点:
D,在D点:
正确答案
(1)0.1mol/(L·min)
(2)BD
(3)A
(4)b>a=d>c
(5)B,<
(6)D
解析
略
知识点
常温下,用 0.1000 



正确答案
解析
略
知识点
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
正确答案
解析
本题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较。溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,高三复习中要反复加强训练。A:在0.1 mol·L-1NaHCO3溶液中,HCO3-在溶液中存在水解与电离两个过程,而溶液呈碱性,说明水解过程大于电离过程,c(H2CO3)>c(CO32-)B:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)中把c(H+)移项到等式另一边,即是一条质子守恒关系式。C:向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液后,相当于0.05 mol·L-1的Na2CO3溶液,Na2CO3在水中水解,OH-包括两步水解和水的电离产物,因此,c(OH-) >c(HCO3-)。D:常温下,CH3COONa和CH3COOH混合溶液,包括CH3COO-水解和CH3COOH电离两个过程,既然pH=7, 根据电荷守恒式,不难得出c(Na+)=c(CH3COO-) =0.1 mol·L-1,c(H+)=c(OH-)=1×10-7 mol·L-1。水解是有限的,c(CH3COOH)约为c(CH3COO-)的百分之一左右。
知识点
部分弱酸的电离平衡常数如下表:
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A,2ClO- + H2O + CO2 → 2HClO + CO32-
B,2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C,H2SO3 + 2HCOO- → 2HCOOH + SO32-
D,Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是
A,H2O2既是氧化剂又是还原剂
B,H2O 既不是氧化产物又不是还原产物
C,H2SeO4既是氧化产物又是还原产物
D,氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸,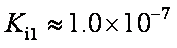
HI+ H6TeO6
(6)若反应中生成的TeO2与Te的物质的量之比为
正确答案
(1)Ki值越大,酸性越强
(2)BD
(3)C(HCOO—)>C(Na+)>C(H+)>C(OH—)
(4)H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4
(5)C
(6)8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O
解析
略
知识点
25℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关离子浓度关系叙述正确的是
正确答案
解析
本题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较。溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,高三复习中要反复加强训练。
ApH=5.5比4.75大,从曲线来看CH3COOH的电离在增大,CH3COO-的水解在减小,不可能出c(CH3COOH)>c(CH3COO-)。BC中W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)是完全正确的,其实这关系在溶液中始终存在。pH=3.5溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-)再把题干中的c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1代入即可。D选项向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡。
溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);
物料守恒关系为:2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 ,不可能得出上述结论。
知识点
扫码查看完整答案与解析