- 离子浓度大小的比较
- 共173题
随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
29.相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
a、b、c、d与m、n、x、y之间的关系式为_________。
30.
碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
等浓度广东草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-] b.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-] d.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
31.人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-
________________________________
32.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)
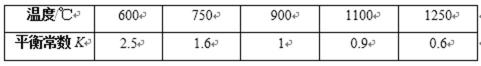
已知H2的体积分数随温度的升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
正确答案
解析
相同温度时平衡常数不变,则a、b、c、d与m、n、x、y之间的关系式为
考查方向
解题思路
平衡常数只是温度的函数,相同温度时平衡常数不变。
易错点
平衡常数表达式不会写。
正确答案
大于;草酸;ac
解析
根据电离常数可知草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,所以0.1 mol/L Na2CO3溶液的pH大于0.1 mol/L Na2C2O4溶液的pH。草酸的酸性强于碳酸,则等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸。A.草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,因此溶液中[H+]>[HC2O4-]>[C2O42-]>[HCO3-]>[CO32-],a正确;B.根据a中分析可知b错误;c.根据a中分析可知c正确;d.根据a中分析可知d错误,答案选ac。
考查方向
解题思路
温度升高,可逆反应的正逆反应速率都增大。根据越弱越水解,草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠。根据勒夏特列原理,判断改变外界条件平衡移动的方向。
易错点
未掌握溶液中离子浓度大小比较的规律。
正确答案
当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。(合理即给分)
解析
根据平衡可知当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。
考查方向
解题思路
人体血液中的碳酸和碳酸氢盐存在平衡,是缓冲溶液,可以对抗外加酸或碱。
易错点
不理解勒夏特列原理中提到的“减弱”的含义。
正确答案
解析
H2的体积分数随温度的升高而增加,这说明升高温度平衡逆反应方向进行,即正反应是放热反应。升高温度正逆反应速率均增大,平衡逆反应方向进行,平衡常数减小,反应物的转化率减小。
考查方向
考查外界条件对平衡状态的影响、电离常数应用等。
解题思路
溶液中的这三大平衡,和普通的化学反应平衡一样,都适用勒夏特列原理,所有关于平衡的原理、规律、计算都是相通的,在学习过程中,不可将他们割裂开来。
易错点
不理解升高温度正逆反应速率均增大。
7.下列溶液中粒子的物质的量浓度关系正确的是( )
正确答案
解析
A.NaH2PO4溶液的pH<7,溶液显示酸性,说明H2PO4-的电离程度大于其水解程度,则c(HPO42-)>c(H3PO4),正确的浓度大小为:c(Na+)>c(H2PO4-)>c(HPO42-)>c(H3PO4),故A错误;
B.0.1mol•L-1(NH4)2SO4溶液与0.1mol•L-1NH3•H2O溶液等体积混合,根据电荷守恒可知:c(NH4+)+c(H+)=2c(SO42-)+c(OH-),故B正确;
C.0.1mol•L-1CH3COONa溶液与0.1mol•L-1CH3COOH溶液等体积混合(pH<7),说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+)可知:c(CH3COO-)>c(Na+)>c(CH3COOH),正确的浓度大小为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),故C错误;
D.0.2mol•L-1NaHCO3溶液与0.1mol•L-1Na2CO3溶液等体积混合,根据物料守恒可得:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D错误
考查方向
本题考查溶液中的离子浓度大小比较知识点
解题思路
A.NaH2PO4溶液的pH<7,说明H2PO4-的电离程度大于其水解程度,则c(HPO42-)>c(H3PO4);
B.根据混合液中的电荷守恒判断;
C.混合液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒可知c(CH3COO-)>c(Na+)>c(CH3COOH);
D.根据混合液中的物料守恒判断
易错点
根据溶液酸碱性判断电离与水解程度的大小,注意物料守恒和电荷守恒等式的应用
教师点评
本题考查溶液中的离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,注意掌握盐的水解原理及其应用方法,试题培养了学生的分析能力及灵活应用能力
知识点
碳及其化合物在科技、社会生产、生活中有着广泛的应用。请按要求回答下列问题:
23.已知:2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1=﹣1214.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=﹣566 kJ/mol
请写出CH4燃烧热的热化学方程式:______________________________________。
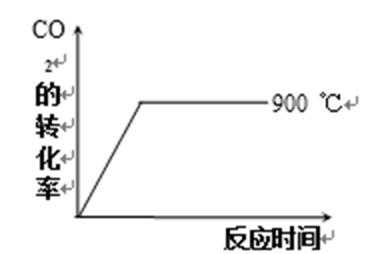
24.在不同温度下反应CO2(g)+H2(g) 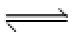
其他条件相同时,请在下图中画出750℃时CO2的转化率随时间变化的示意图。
25.以二甲醚(CH3OCH3)、空气、KOH溶液为原料可设计为燃料电池
①放电时,负极电极反应式:______________________________________。
②假设该燃料电池中盛有100.0 mL 3.0 mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72 L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为_____________________________________________。
正确答案
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol
考查方向
本题考查了热化学方程式的书写及燃烧热的概念
解题思路
根据燃烧热的定义,写方程式是可燃物只能是1mol:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=1/2△H1+1/2 △H2=-890.3 kJ/mol
易错点
忽略可燃物只能是1mol,即燃烧热的定义。
教师点评
本题考查了热化学方程式的书写,盖斯定律的应用及燃烧热的定义,在高考中出现频率高。
正确答案
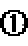
考查方向
本题考查了化学平衡常数、化学平衡移动,化学反应速率,图像等知识点及学生分析图表获取信息的能力。
解题思路
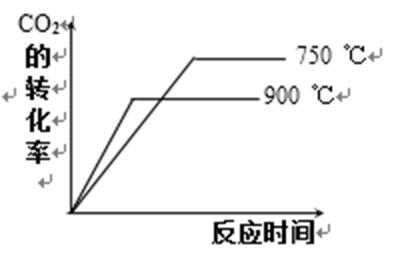
根据第一空,该反应为放热反应,750。C时,温度降低,速率减慢,达到平衡的时间变长,拐点延后,但平衡正移,二氧化碳转化率增大,平台高。
易错点
平衡移动和反应速率的影响结果混淆。
教师点评
本题考查了化学平衡常数、化学平衡移动,化学反应速率,图像等知识点及学生分析图表获取信息的能力。在高考中出现频率较高,但全国卷对该部分内容的考查难度稍大,本题难度较小。
正确答案
CH3OCH3-12e-+ 16OH-=2CO32-+11H2O(2分)
c(K+)>c (HCO3-)>c (CO32-)>c (OH-)>c( H+ ) (1分)
解析
由题意可知:
n(O2)=6.72/22.4 mol =0.3mol n(KOH)=0.3mol
n(e-)=4n(O2)=1.2mol 根据电子得失守恒:
n(CO2)=0.2mol
2KOH+ CO2= K 2 CO+ H 2 O
0.3 0.15 0.15
K 2 CO3+ H 2 O+ CO2=2KHCO3
0.05 0.05 0.1
即最终为n(K 2 CO3)=n(KHCO3)
碳酸钠水解程度大于碳酸氢钠,故得到答案结果。
考查方向
本题考查了燃料电池电极反应式书写、离子浓度大小的比较、计算等知识点。
解题思路
CH3OCH3-12e-+ 16OH-=2CO32-+11H2O
解题步骤:负极二甲醚放电,溶液呈碱性,碳元素的存在形态为CO32-,分析碳元素化合价,写出失去电子数,在根据电荷守恒配平OH-,根据原子守恒配平H2O
燃料电池都可以用这个模式来解题。
第二空见解析。
教师点评
本题考查了燃料电池电极反应式书写、离子浓度大小的比较、计算等知识点。难度较大,考查学生综合能力,在高考中出现频率中等。
扫码查看完整答案与解析