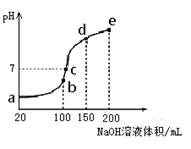- 离子浓度大小的比较
- 共173题
弱酸酸式盐的酸根离子电离和水解并存,已知HSO—3电离大子水解。以NaHXO3表示NaHCO3和NaHSO3。对于NaHCO3和NaHSO3溶液,下列关系式中不正确的是
正确答案
解析
略
知识点
近两年我国大多城市都受到雾霾天气的影响,雾霾的形成与氮的氧化物和硫的 氧化物有关:
已知:2SO2(g)+O2(g)
2NO(g)+O2(g)
(1)则反应NO2(g)+SO2(g)
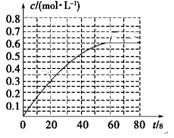
(2)某温度时,在一个容积为10L的密闭容器中进行反应①。开始充入4。0 mol SO2和2。0 molO2,半分钟后达到平衡,并放出352。8 kJ的热量。此时SO2的转化率是 ___________,该温度下的平衡常数K=____________。
(3)利用钠碱循环法可脱除工业废气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是___________________。
②吸收液吸收SO2的过程中,pH随n(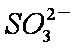
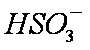
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母)_____________。
a。c(Na+)=2c(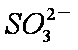
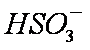
b。c(Na+)>c(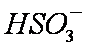
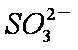
c。c(Na+)+c(H+)=c(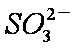
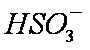
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性, 原因是__________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,所滴加氨水的浓度为_________mol·L-1(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)。
正确答案
(1) —41.8
(2)90% 4050
(3)①2OH-+SO2===H2O+SO ②ab
(4)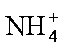

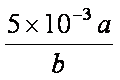
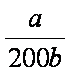
解析
略
知识点
在0.1mol/L的Na2CO3的溶液中,下列关系式正确的是
正确答案
解析
略
知识点
I: 已知在常温常压下:
① 2CH3OH(l)十3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l) H2O(g) △H=+ 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
II:磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
(1)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为 。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是 。(填选项字母)
a、 C(Na+)> C(H2PO4 -)> C(H+)> C(HPO4 2-)> C(H3PO4 )
b、 C(Na+)> C(H2PO4 -)> C(OH-)> C( H3PO4)> C(HPO4 2- )
c、 C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )
d、 C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh (写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
III,化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如下图所示。
电源正极为 (填A或B),阴极反应式为 。
正确答案
见解析
解析
I:CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(l) △H=-725.8kJ/mol (2分)
II:(1)> HPO4 2- + H+ === H2PO4 - (每空2分,共4分)
(2)ad(2分)
(3)PO43- + H2O 
起始浓度(mol·L–1): 0.1 0 0
变化浓度(mol·L–1): 0.01 0.01 0.01
平衡浓度(mol·L–1): 0.09 0.01 0.01 (1分)
Kh === C (HPO4 2-)× C(OH-)/ C( PO43- )=== 0.01 × 0.01 / 0.09 === 1.1 × 10 -3 mol·L–1
(2分,共4分)
II: A
2NO3-+10e-+12H+=6H2O +N2↑ (每空2分,共4分)
知识点
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号F火箭的燃料是液态偏二甲肼(CH3-NH-NH-CH3),氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________。
(2)298K时,在2L的密闭容器中,发生可逆反应:2NO2(g)
①298k时,该反应的平衡常数为________L ·mol-1。
②下列事实能判断该反应处于平衡状态的是________。
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c. V(N2O4)正=2V(NO2)逆
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时
V(正)________V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是________。
③在c点,溶液中各离子浓度由大到小的排列顺序是________。
正确答案
(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ·mol-1
(2)①6.67;②b;③<
(3)①b;②d;③c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)
解析
略。
知识点
扫码查看完整答案与解析