- 原子团
- 共4题
4.硫黄制酸在我国的工业发展进程中具有重要地位,其工业流程示意图如下。已知硫黄的燃烧热
正确答案
解析
A因在Ⅰ中硫黄已经为熔融状态,所以Ⅱ中的热方程式是 A选项因在Ⅰ中硫黄已经为熔融状态,所以Ⅱ中的热方程式是 S(l)+O2(g)-----SO2(g) ΔH=-297kJ.mol-1
B.接触室Ⅳ发生的反应是
C.选项Ⅳ过程中加催化剂只能加快反应速率,不能提高转化率.
D.Ⅴ中气体a中的气体含有SO2,直接排放对大气有污染。
考查方向
解题思路
对该反应装置进行观察与分析,可得出Ⅱ、Ⅳ中的反应方程式。根据催化剂的性质可得催化剂的作用是提高化学反应速率和平衡转化率。由于气体a中含有二氧化硫,所以不能直接排放到大气中。
易错点
对硫元素的物理状态认识不清。
知识点
某同学看到“利用零价铁还原

i.打开弹簧夹,缓慢通入

ii.加入pH 已调至2.5 的 0.

iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在
21.通入
22.白色物质是_________,用化学方程式解释其变为红褐色的原因:_________。
23.用

24.⑷取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色。溶液变成红色的原因是_________。
25.该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳。他用上述
设计如下实验,探究碳粉的作用。
③关于碳粉的作用,还可以提出的假设是 。
正确答案
避免空气中O2对Fe和NO3-反应的干扰。
解析
因为实验过程涉及氧化还原反应,所以需要排除空气中O2对于实验产生的影响。
考查方向
解题思路
对反应装置进行分析可知在氮气环境下进行反应的目的是为了防止氧气对反应的影响。
易错点
对元素化合价计算错误导致化学方程式书写错误
正确答案
Fe(OH)2 4Fe(OH)2+O2+H2O=4Fe(OH)3
解析
基础内容,考查课内方程式书写。
考查方向
解题思路
对反应装置进行分析可知在氮气环境下进行反应的目的是为了防止氧气对反应的影响。
易错点
对元素化合价计算错误导致化学方程式书写错误
正确答案
取滤液,向其中滴加几滴K3[Fe(CN)6]。若观察到蓝色沉淀,则证明滤液中存在Fe2+。
解析
考查Fe2+和K3[Fe(CN)6]反应实验现象。
考查方向
解题思路
对反应装置进行分析可知在氮气环境下进行反应的目的是为了防止氧气对反应的影响。
易错点
对元素化合价计算错误导致化学方程式书写错误
正确答案
溶液中存在Fe2+和NO3-,加入H+后,发生反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。生成的Fe3+和SCN-反应使溶液变红。
解析
Fe2+具有还原性,NO3-在有H+存在的情况下具有氧化性,二者发生反应。生成的Fe3+和SCN-反应使溶液变成血红色。
考查方向
解题思路
对反应装置进行分析可知在氮气环境下进行反应的目的是为了防止氧气对反应的影响。
易错点
对元素化合价计算错误导致化学方程式书写错误
正确答案
① 碳粉和pH=2.5的0.01mol/L KNO3溶液100mL
②Fe电极部分溶解,电流计指针偏转,右杯中NO3-浓度降低。
③碳粉作为催化剂,提高脱除硝酸盐反应速率。
解析
① 探究的是碳粉直接和NO3-反应效果,所以直接加入碳粉即可。溶液的选取尽可能
和原题完全相同,请标清KNO3溶液的浓度体积和pH值
考查方向
解题思路
对反应装置进行分析可知在氮气环境下进行反应的目的是为了防止氧气对反应的影响。
易错点
对元素化合价计算错误导致化学方程式书写错误
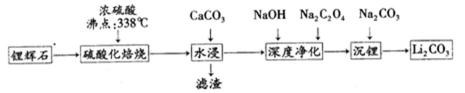
碳酸锂(相对分子质量74)广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业。制备流程如下:
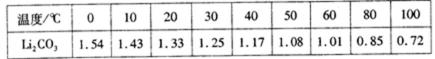
已知:碳酸锂的溶解度为( g/L)
16.锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为____ 。
17.硫酸化焙烧工业反应温度控制在250 - 300℃,主要原因是_______ _;同时,硫
酸用量为理论耗酸量的115%左右,硫酸如果加入过多则 (填入选项代号)。
A.增加酸耗量
B.增加后续杂质的处理量
C.增加后续中和酸的负担
18.水浸时,需要在搅拌下加入石灰石粉末的主要作用是________。
19.“沉锂”的化学反应方程式为 。
20.“沉锂”需要在95℃以上进行,主要原因是 。过滤碳酸锂所得母液
中主要含有硫酸钠,还可能含有____和______。
正确答案
Li2O·Al2O3·4SiO2
解析
锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示,其组成形式为:Li2O·Al2O3·4SiO2,
故答案为:Li2O·Al2O3·4SiO2
考查方向
解题思路
锂辉石加硫酸,浸取焙烧,氧化铝、氧化锂溶解,二氧化硅不反应,水浸时加入碳酸钙,除去为反应的硫酸,同时调节溶液pH值,可以将Al3+转化为Al(OH)3沉淀,过滤除去不溶物,滤液再进行深度净化后主要为Li2SO4、Na2SO4,最后加入Na2CO3,转化为溶解度更小Li2CO3析出。
易错点
本题是对学生综合能力的考查,关键是对工艺流程的理解,难度较大
正确答案
温度低于250℃,反应速率较慢
解析
温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多,反应温度控制在250﹣300℃,反应速率较快,避免硫酸挥发;
硫酸如果加入过多,消耗的酸多,后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担。
故答案为:温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多;ABC
考查方向
解题思路
锂辉石加硫酸,浸取焙烧,氧化铝、氧化锂溶解,二氧化硅不反应,水浸时加入碳酸钙,除去为反应的硫酸,同时调节溶液pH值,可以将Al3+转化为Al(OH)3沉淀,过滤除去不溶物,滤液再进行深度净化后主要为Li2SO4、Na2SO4,最后加入Na2CO3,转化为溶解度更小Li2CO3析出。
易错点
本题是对学生综合能力的考查,关键是对工艺流程的理解,难度较大
正确答案
除去多余的硫酸,同时调整pH,除去大部分杂质。
解析
加入碳酸钙除去未反应的硫酸,同时调节溶液pH值,除去大部分杂质。
故答案为:除去多余的硫酸,同时调整pH,除去大部分杂质
考查方向
解题思路
锂辉石加硫酸,浸取焙烧,氧化铝、氧化锂溶解,二氧化硅不反应,水浸时加入碳酸钙,除去为反应的硫酸,同时调节溶液pH值,可以将Al3+转化为Al(OH)3沉淀,过滤除去不溶物,滤液再进行深度净化后主要为Li2SO4、Na2SO4,最后加入Na2CO3,转化为溶解度更小Li2CO3析出。
易错点
本题是对学生综合能力的考查,关键是对工艺流程的理解,难度较大
正确答案
Na2CO3+Li2SO4=Li2CO3↓+Na2SO4
解析
“沉锂”过程是碳酸钠与Li2SO4反应生成Li2CO3,反应方程式为:Na2CO3+Li2SO4=Li2CO3↓+Na2SO4故答案为:Na2CO3+Li2SO4=Li2CO3↓+Na2SO4
考查方向
解题思路
锂辉石加硫酸,浸取焙烧,氧化铝、氧化锂溶解,二氧化硅不反应,水浸时加入碳酸钙,除去为反应的硫酸,同时调节溶液pH值,可以将Al3+转化为Al(OH)3沉淀,过滤除去不溶物,滤液再进行深度净化后主要为Li2SO4、Na2SO4,最后加入Na2CO3,转化为溶解度更小Li2CO3析出。
易错点
本题是对学生综合能力的考查,关键是对工艺流程的理解,难度较大
正确答案
温度越高,碳酸锂溶解度降低,可以增加产率
碳酸钠、碳酸锂
解析
温度越高,碳酸锂溶解度降低,减少碳酸锂溶解,可以增加产率;溶液中硫酸钠不反应,使用的碳酸钠要过量,少量碳酸锂溶解在溶液中,过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠、碳酸锂,故答案为:温度越高,碳酸锂溶解度降低,可以增加产率。
考查方向
解题思路
锂辉石加硫酸,浸取焙烧,氧化铝、氧化锂溶解,二氧化硅不反应,水浸时加入碳酸钙,除去为反应的硫酸,同时调节溶液pH值,可以将Al3+转化为Al(OH)3沉淀,过滤除去不溶物,滤液再进行深度净化后主要为Li2SO4、Na2SO4,最后加入Na2CO3,转化为溶解度更小Li2CO3析出。
易错点
本题是对学生综合能力的考查,关键是对工艺流程的理解,难度较大
1.下列表示物质结构的化学用语或模型正确的是
正确答案
解析
A.次氯酸的中心原子为O,HClO的结构式为:H-O-Cl,故A正确;
B.HF是共价化合物,不存在离子键,分子中氟原子与氢原子形成1对共用电子对,电子式为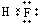
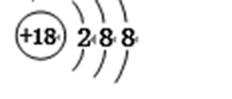
C.硫离子质子数为16,核外电子数为18,有3个电子层,由里到外各层电子数分别为2、8、8,离子结构示意图为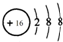
D.氯原子的半径比碳原子的大,中心原子的半径小,故D错误;
考查方向
化学用语
解题思路
A.次氯酸分子中含有1个H-O键和1个O-Cl键;
B.HF是共价化合物,不存在离子键,分子中氟原子与氢原子形成1对共用电子对;
C.硫离子质子数为16,核外电子数为18,有3个电子层,由里到外各层电子数分别为2、8、8;
D.氯原子的半径比碳原子的大
易错点
D项氯原子的半径比碳原子的大
教师点评
本题考查了常见化学用语的表示方法判断,题目难度中等,涉及电子式、离子结构示意图、球棍模型与比例模型、结构式等知识
知识点
扫码查看完整答案与解析