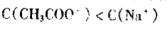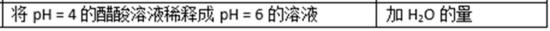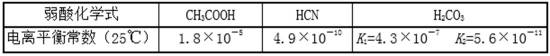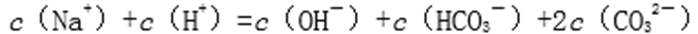- 弱电解质在水溶液中的电离平衡
- 共87题
室温下有下列四种溶液:①0.1 mol/L氨水 ②0.1 mol/L NH4Cl溶液 ③混合溶液:盐酸和NH4Cl的浓度均为0.1 mol/L ④混合溶液:NaOH和氨水的浓度均为0.1 mol/L。四种溶液中c(NH4+)由大到小排列正确的是()
正确答案
解析
略
知识点
10.下列有关电解质溶液的叙述符合科学性的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.室温条件下进行下列各组实验,其中的观察要点不能说明醋酸是弱电解质的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.常温下向10 mL,0.1mol/L氨水中缓缓加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(H+)增大 ③导电性增强
④
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9、下列四种溶液中:①pH值为0的盐酸;②0.1mol/L的盐酸;③0.01mol/L的氢氧化钠溶液;④pH值为11的氢氧化钠溶液。由水电离生成的c(H+)之比依次为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. A、B、C、 D、 E五种溶液分别是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一种。常温下进行下列实验:Ⅰ.将1 L pH=2的A溶液分别与0.01mol/L V1L B溶液、0.01mol/LV2L D溶液充分反应至中性,V2<V1;Ⅱ.浓度均为0.1mol·L-1A和E溶液,pH:A<E;Ⅲ.浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。回答下列问题:
(1)D分别是( )。
(2)常温下用水稀释0.1 mol/L B时,溶液中随着水量的增加而减小的是( )(填序号)
①c(H+)和c(OH-)的乘积 ②OH-的物质的量 ③
(3)等体积pH相同的A和E溶液,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填序号)
①开始反应时的速率A>E ②反应过程的平均速率 E>A
③反应所需要的时间E>A ④参加反应的锌粉物质的量A=E
⑤E溶液里有锌粉剩余 ⑥A溶液里有锌粉剩余
(4)用Pt电极电解A溶液,阳极的电极反应式为 ( )。
(5)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不发生分解) ,溶液pH随温度变化如下图中的_________曲线(填写序号) 。
(6)常温下,向0.01mol mol/L C溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为( )。
正确答案
(1)NaOH
(2)③
(3)②④⑥
(4)2Cl--2e-=Cl2↑
(5) ④
(6)
解析
解析已在路上飞奔,马上就到!
知识点
28.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
请回答下列问题:
(1)常温下,某氨水的pH =12,则水电离的c(OH—)=( )。若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度( )(填“大于”、“等于”或“小于”)氨水中水的电离程度。
(2)合成氨反应
(3)一定温度下,在密闭容器中可发生下列反应:

(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通人空气,另一电极通入NH3。其电池反应式为:4NH3+3O2=2N2 +6H2O。你认为电解质溶液应显( )(填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.对于常温下0.0l mol/L的氨水,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.(1)已知pH =2的高碘酸(
已知


(2)体积不变的密闭容器内部有一不漏气且可滑动的话塞将容器分成左右两个室,左室内充入一定体积的CO和H2O气体,右室充人SO2和O2两种气体共4mol,且SO2和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
反应开始时活塞停留在离左端点
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析