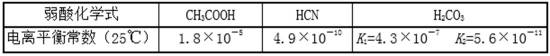- 弱电解质在水溶液中的电离平衡
- 共87题
12.常温下向10 mL,0.1mol/L氨水中缓缓加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(H+)增大 ③导电性增强
④
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9、下列四种溶液中:①pH值为0的盐酸;②0.1mol/L的盐酸;③0.01mol/L的氢氧化钠溶液;④pH值为11的氢氧化钠溶液。由水电离生成的c(H+)之比依次为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
请回答下列问题:
(1)常温下,某氨水的pH =12,则水电离的c(OH—)=( )。若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度( )(填“大于”、“等于”或“小于”)氨水中水的电离程度。
(2)合成氨反应
(3)一定温度下,在密闭容器中可发生下列反应:

(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通人空气,另一电极通入NH3。其电池反应式为:4NH3+3O2=2N2 +6H2O。你认为电解质溶液应显( )(填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.对于常温下0.0l mol/L的氨水,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析