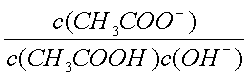- 弱电解质在水溶液中的电离平衡
- 共87题
1
题型:
单选题
|
室温下向10 mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
正确答案
B
解析
醋酸是弱电解质,加水稀释时电离程度增大,溶液中导电粒子的数目是增多的,但粒子的浓度要减小,故A、C错;电离平衡常数只与温度有关,故B正确;10mL pH=11的NaOH溶液只能反应掉10mL pH=3的醋酸溶液中电离出的H+,还有大量的未电离的醋酸没有反应,故溶液显酸性,D错。
知识点
弱电解质在水溶液中的电离平衡
1
题型:
单选题
|
H2S水溶液中存在电离平衡H2S

正确答案
C
解析
略
知识点
弱电解质在水溶液中的电离平衡
1
题型:
单选题
|
一定温度下,下列溶液的离子浓度关系式正确的是
正确答案
D
解析
略
知识点
弱电解质在水溶液中的电离平衡pH的简单计算
1
题型:
单选题
|
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL,浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
正确答案
D
解析
略
知识点
弱电解质在水溶液中的电离平衡
1
题型:
单选题
|
光谱研究表明,易溶于水的S02所形成的溶液中存在着下列平衡:
据此,下列判断中正确的是
正确答案
A
解析
本题主要考察化学平衡状态的特点和外界条件对化学平衡对影响。因为该反应是可逆反应,所以达到平衡后反应物和生成物共同存在与体系中,所以选项A正确;溶液中H+的来源有3个方面,即水的电离、SO2·xH2O和HSO3-的电离,因此溶液中H+浓度不一定是SO32-浓度的2倍,选项B错误;SO2是一种还原性气体,若加入的酸是氧化性酸,SO2将被氧化成硫酸而不会放出SO2气体,选项C错误;NaHSO3是一种酸式盐可以与NaOH反应,方程式为NaHSO3+NaOH=Na2SO3+H2O,选项D也错误。
知识点
化学平衡移动原理弱电解质在水溶液中的电离平衡含硫物质的性质及综合应用
下一知识点 : 水的电离
扫码查看完整答案与解析