- 弱电解质在水溶液中的电离平衡
- 共87题
10.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是( )
正确答案
B
解析
先加入稀硝酸,因其具有强氧化性,如果溶液中含有SO32-等也会形成BaSO4白色沉没,A错误。如果溶液中含有NH4+遇碱、加热会产生氨气,使湿润的红色石蕊试纸变红,B正确。两饱和溶液中的A-与 B- 的浓度不一定相同,无法判断水解程度的大小,C错误。蔗糖溶液水解得到的还原性糖与新制Cu(OH)2悬浊液的反应应当在碱性环境下进行,必须加入氢氧化钠中和多余的酸,D错误。
考查方向
解题思路
把握现象与结论之间的因果关系,加强重点实验的学习。
易错点
实验现象与结论之间的因果关系。
知识点
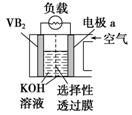
11.硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时反应为4VB2+11O2===4B2O3+2V2O5。下列说法正确的是
正确答案
解析
硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,所以X为正极,故A错误;B、原电池中,阴离子向负极移动,阳离子向正极移动,所以溶液中的OH-向另一极移动,故B错误;C、电子通过外电路由负极向正极移动,溶液中只有离子的移动。故C错误D、负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O,故D正确.本题正确答案是D
考查方向
解题思路
A、根据原电池中负极失电子来判断;B、原电池溶液中阴离子向负极移动;C、电子通过外电路由负极向正极移动,D、负极上是VB2失电子发生氧化反应.
易错点
原电池的工作原理,电极反应式的判断。
知识点

正确答案
解析
A.正极发生还原反应,为Fe3++e-═Fe2+,故A错误;
B.左边烧杯中发生Fe3++e-═Fe2+,则左烧杯中溶液的红色逐渐变浅,故B正确;
C.阴离子向负极移动,故C错误;
D.若将甲烧杯中的溶液换成稀硝酸,可氧化铜,铜为负极,电流表指针偏转方向不变,故D错误.
故选B.
考查方向
原电池和电解池的工作原理
解题思路
该原电池反应为Cu+2FeCl3═2FeCl2+CuCl2,则负极为Cu,发生Cu-2e-=Cu2+,阳离子移动到正极,左边烧杯中发生Fe3++e-═Fe2+,以此来解答。
易错点
根据失电子难易程度确定正负极。
知识点
17.某溶液中只可能含有
正确答案
解析
①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,且有气泡冒出,说明溶液中含离子CO32-或SO32-;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32-,那么一定含有:CO32-,一定不能含有与碳酸根生成沉淀的离子:Al3+、Mg2+,通过以上分析,根据电中性原理,能证明K+存在,所以无法判断氢氧根离子的存在与否,可以取样,加入足量BaCl2溶液,再滴加紫色石蕊试液看是否变红来检验
考查方向
常见离子的检验
解题思路
①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,且有无色气泡冒出,说明溶液中含离子CO32-或SO32-离子,那么与其混合生成沉淀的不能存在;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32-,据此进行解答
易错点
用溶液的电中性判断含有K+
教师点评
本题考查离子的检验及离子共存问题,题目难度中等,注意掌握常见离子的性质及检验方法,明确常见离子的反应的现象,然后结合离子的性质进行判断
知识点
19.离子方程式Ba2+ + 2OH-+ 2H+ + SO42-→ BaSO4↓ + 2H2O可表示
正确答案
解析
A.Ba(OH)2与NaHSO4两溶液的溶质按物质的量之比2:1反应时的离子反应为Ba2++OH-+H++SO42-=BaSO4↓+H2O,故A不选;
B.Ba(OH)2与NaHSO4两溶液的溶质按物质的量之比1:2反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B选;
C.Ba(OH)2与NH4HSO4两溶液的溶质按物质的量之比2:1反应的离子反应为Ba2++2OH-+NH4++H++SO42-=BaSO4↓+H2O+NH3.H2O,故C不选;
D.Ba(OH)2与NH4HSO4两溶液的溶质按物质的量之比1:2反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D选
考查方向
离子方程式的书写
解题思路
Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O可表示氢氧化钡与硫酸(或硫酸的酸式盐)反应的离子反应,以此来解答
易错点
CD项中:OH-与H+、NH4+的反应顺序
教师点评
本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,注意量少的物质完全反应,题目难度不大
知识点
扫码查看完整答案与解析