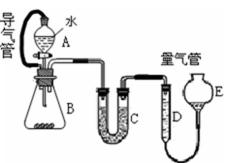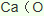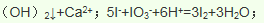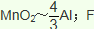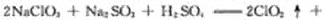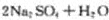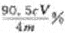- 金属及其化合物
- 共561题
4.下列不正确的是()
正确答案
解析
根据离子的电荷守恒,c(Na+)+c(K+)+c(H+)=c(OH- )+c(CH3COO-)+c(Cl-),因为KCl是强电解质,因为c(K+)=c(Cl-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+),故A正确;
相同浓度CH3COONa和NaClO的混合液中,CH3COOH较HClO的酸性强,因此CH3COO-较ClO-电离程度大,因此各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故B错误;
如果HA是强酸,则消耗HA的溶液体积是10ml。如果HA弱酸,则消耗HA的溶液体积小于10ml,故C正确;
因为是恰好反应,所以产物恰好生成NH4Cl,即c(NH4+)+c(NH3•H2O)+c(NH3)=c(Cl- )=0.1/2=0.05mol/l,故D正确。
考查方向
解题思路
A:根据离子的电荷守恒,c(Na+)+c(K+)+c(H+)=c(OH- )+c(CH3COO-)+c(Cl-),因为KCl是强电解质,因此c(K+)=c(Cl-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+);
B:相同浓度CH3COONa和NaClO的混合液中,CH3COOH较HClO的酸性强,因此CH3COO-较ClO-电离程度大,因此各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+);
C:如果HA是强酸,则消耗HA的溶液体积是10ml。如果HA弱酸,则消耗HA的溶液体积小于10ml;
D:因为是恰好反应,所以产物恰好生成NH4Cl,即c(NH4+)+c(NH3•H2O)+c(NH3)=c(Cl- )=0.1/2=0.05mol/l
易错点
忽略溶液的酸碱性,对弱酸、弱碱的性质理解不够透彻
知识点
12.已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2+ + 2S2O32- +O2 + 4OH-= Fe3O4 + S4O62- +2H2O, 下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.“十二五”(2011-2015年)末期,随着铁路的建设发展,一票难求的情况将从根本上改观,或者说将成历史。下列有关说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.依据原电池原理,设计番茄电池并检测电流的产生,其中合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.常温下,下列溶液的离子浓度关系式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为1︰6,则该反应的还原产物是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
18.氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中被富集。海洋开发利用和维权是国家战略。
(1)以上元素在海水中的存在形态是__________(选填①游离态 ②化合态 ③不确定)
(2)以下变化属于化学变化的是______________________:
①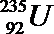
②重氢(2H)发生核聚变
③LiH做野外生氢剂
④海水晒盐
(3)由氯气和晒盐后的卤水制取液溴的离子方程式______________________________;由石灰乳和卤水沉淀出镁元素的离子方程式______________________________________;由海带灰可浸出KI,由某种矿盐可浸出KIO3,二者在盐酸中反应可生成碘单质,反应的离子方程式_________________________________。
(4)工业由氯化钠制取金属钠的化学方程式为__________________________________;工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是_________________________。
(5)海底富集多种矿物结核,锰结核是其中的一种。锰结核中主要含有MnO2和Fe2O3。一种质量比约为m(Mn):m(Fe)=55:448的合金钢(其它元素略),具有抗御激烈冲击和磨损的能力,可做航母甲板等。欲通过铝热反应炼得这样的合金,MnO2、Fe2O3、Al的投料比(按物质的量之比)约为______________。
正确答案
(1)氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中主要是以离子的形式存在,即是以化合态存在的,故答案为:②;
(2)LiH做野外生氢剂是有新物质生成的变化,属于化学变化,
 )发生核聚变、海水晒盐没有新物质生成,是物理变化,故答案为:③;
)发生核聚变、海水晒盐没有新物质生成,是物理变化,故答案为:③;(3)氯气具有氧化性,能将溴离子氧化为溴单质卤水制取液溴的离子方程式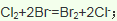
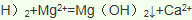
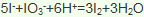
(4)金属钠是活泼金属,电解熔融的氯化钠可以制取金属钠:
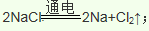
(5)质量比约为m(Mn):m(Fe)=55:448的合金钢中Mn元素和Fe元素的物质的量之比是1:8,根据原子守恒,投料MnO2、Fe2O3的物质的量之比是1:4,根据铝热反应实质,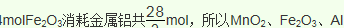
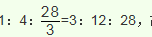
解析
解析已在路上飞奔,马上就到!
知识点
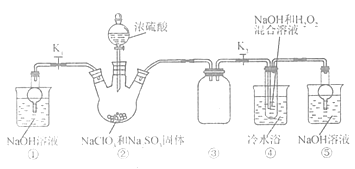
26. 某化学兴趣小组同学展开对漂白剂制亚氯酸钠(NaClO2)的研究。
实验I: 制取NaClO2 晶体
已知:NaClO2 饱和溶液在①温度低于38℃时析出晶体是NaClO2.H2O ②温度离于38℃时析出晶体是NaClO2 ③温度高于60℃时NaClO2分解成NaClO3和NaCl。
现利用如图所示装置进行实验。
(1)装置里③的作用是__________________________。
(2)装置中产生的ClO2化学方程式_______________________。装置④中制备NaClO2的化学方程式为_______________________。
(3)从装置反应后的溶液获得NaClO2晶体的操作步骤为①减压,55℃蒸发结晶,趁热过滤;③_______________________。④低手6℃干燥,得到成品。
实验II: 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加人适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应后,加蒸馏水至250 ml。(已知:
②移取25.00mL待测液于锥形瓶中,加几滴淀粉溶液,用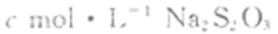
定,至滴定终点。重复2次,测得平均值为VmL(己知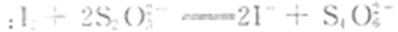
(4)达到滴定终点时的现象为_____________________________________。
(5)该样品中NaClO2(分子量=90.5)的质量分数为_______________________(用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验侧得结果偏高。原因用离子方程式表示为____
___________________。
正确答案
(1)安全瓶或防止倒吸
(2)
(3)用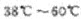
(4)滴入最后一滴,溶液刚好由蓝色变为无色,且在半分钟内不变色。
(5)
(6)
解析
解析已在路上飞奔,马上就到!
知识点
3.下列有关化学用语表示正确的是
正确答案
解析
A.二氧化碳的化学式为CO 2 ,碳和氧位于同一周期,从左到右原子半径逐渐减小,故碳的原子半径较大,故A错误;
B.硫离子核内含有16个质子,核外有3个电子层,最外层有8个电子,其结构示意图:
C. 原子符号中左上角的数字表示质量数,质量数=质子数+中子数,则中子数为20的氯原子表示为
D.HCN分子中存在C-H和C≡N,其结构式为H-C≡N,故正确;
考查方向
本题主要考查了核素;质量数与质子数、中子数之间的相互关系、化学用语的书写。
解题思路
A.二氧化碳的化学式为CO 2 ,碳和氧位于同一周期,从左到右原子半径逐渐减小,故碳的原子半径较大,故A错误;
B.硫离子核内含有16个质子,核外有3个电子层,最外层有8个电子,其结构示意图:
C. 原子符号中左上角的数字表示质量数,质量数=质子数+中子数,则中子数为20的氯原子表示为
D.HCN分子中存在C-H和C≡N,其结构式为H-C≡N,故正确;
易错点
1、化学用语的书写。
2、结构式的书写。
知识点
8.下列说法正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析