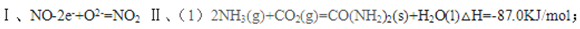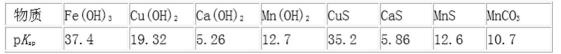- 金属及其化合物
- 共561题
22.2015年九月末爆发的德国大众柴油车尾气排放作弊事件引起了公众的关注。柴油车尾气中常含有大量氮氧化物,通常会采用喷射尿素溶液的方法,将有毒的氮氧化物还原成无污染的物质。大众选择了一种违规做法,即在客户平时用车时不开启喷射尿素的尾气后处理系统,而是通过软件让这一系统只在尾气排放检测时启动
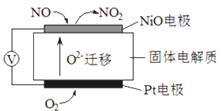
Ⅰ、通过NOx传感器可监测空气的NOx的含量,其工作原理图如下图,写出NiO电极的电极反应式_________________;
Ⅱ、以CO2与NH3为原料可合成尿素。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s)+l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)-116.5kJ•mol-1
③H2O(l)=H2O(g)-44.0kJ•mol-1
(1)写出CO2与NH3合成尿素和液态水的热化学反应方程式___________;
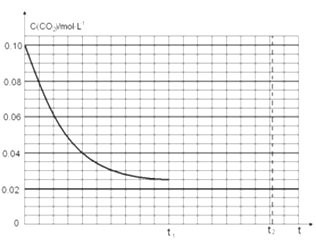
(2)恒温下将0.8molNH3和0.4molCO2放入容积为4L的密闭容器中,反应生成NH2CO2NH4(s),t1时达到平衡。则平衡时CO2的转化率是_______________。若其他条件不变,t1时将容器体积压缩到2L。请画出t1后c(CO2)随时间t变化曲线(t2达到新的平衡)。
Ⅲ、尿素在一定温度下可分解生成NH3,NH3催化还原NxOy可以消除氮氧化物的污染。已知:反应a:4NH3(g)+6NO(g)


(1)相同条件下,反应a在2L密闭容器内,选用不同的催化剂,反应产物N2的量随时间变化如图所示。下列说法正确的是________________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,NO2体积分数_____(填“变大”、“变小”或“不变”);
(3)恒温恒容容器中,反应c达到平衡;若起始投料相同,起始温度和压强相同,若反应在恒温恒压容器中进行,则NH3的转化率将_____________(填“变大”、“变小”或“不变”)。
正确答案
(2)75% ;
Ⅲ、(1)AD (2)变大 (3)变大
解析
I NiO 电极上NO失去电子生成NO2为负极,发生氧化反应,NiO 电极的电极反应式:NO-2e-+O2-=NO2。
II(1)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式。依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
(2)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时, 2NH3(g)+CO2(g)⇌NH2CO2NH4(s)
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.15 0.075
平衡量(mol/L) 0.05 0.025
进而可以求出转化率=0.15/0.2=75%;t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图所示。若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol/L,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变,据此画出变化曲线为:,故答案为:75%
Ⅲ、(1)A.由于A点生成的N2大于B点,即条件A的反应速率大于B,活化能越小,反应速率越大,Ea(B)>Ea(A),同理可知Ea(C)>Ea(B),所以该反应的活化能大小顺序是:Ea(C)>Ea(B)>Ea(A),所以A错误。B.增大压强,使浓度增大,活化分子浓度增加,而活化分子百分数不变所以,B错误;C.单位时间内H-O键与N-H键断裂的数目相等时,说明正逆反应速率相等,反应已经达到平衡,所以C正确;D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明容器中温度不发言变化,即反应已经达到平衡,所以C正确。故答案为:CD
(2)一定条件下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,恒温恒压条件下,再充入NO2气体,则与原来的平衡为等效平衡,则NO2体积分数与原来平衡相同;若恒温恒容容器中,再充入NO2气体,容器中压强增大,与原来平衡相比较,平衡正向移动,则NO2体积分数变大;故答案为:变大。
(3)恒温恒容容器中,反应4NH3(g)+6NO2(g)
考查方向
考查了原电池电极反应的书写、题考查了化学平衡影响因素分析判断、平衡常数的应用、反应速率计算、平衡状态的判断等,侧重于考查学生对基础知识的综合应用能力。
解题思路
I NiO 电极上NO失去电子生成NO2为负极,发生氧化反应,NiO 电极的电极反应式:NO-2e-+O2-=NO2。
II(1)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式。依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
(2)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时,
2NH3(g)+CO2(g)⇌NH2CO2NH4(s)
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.15 0.075
平衡量(mol/L) 0.05 0.025
进而可以求出转化率;t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图所示。若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol/L,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变;
Ⅲ、(1)A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C)。
B.增大压强,使浓度增大,活化分子浓度增加,而活化分子百分数不变;
C.单位时间内H-O键与N-H键断裂的数目相等时,说明正逆反应速率相等,反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明容器中温度不发言变化,即反应已经达到平衡。
(2)一定条件下,反应2NO(g)+O2(g)
(3)恒温恒容容器中,反应4NH3(g)+6NO2(g)
易错点
不能准确判断电极材料致错、不能熟练应用盖斯定律致错,没有理解化学平衡的本质特点致错。
知识点
6.下列反应中,反应后固体质量一定减少的是
正确答案
解析
A.水蒸气通过Na2O2固体生成氢氧化钠和氧气,2Na2O2+2H2O = 4NaOH+O2↑,固体质量增加,错误;
B.镁粉投入FeCl3溶液中,在FeCl3溶液中存在 FeCl3+3H2O
C.铝粉与Fe2O3发生铝热反应,Fe2O3+2Al=Al2O3+2Fe,固体质量不变,错误;
D.焦炭在电炉中还原二氧化硅,SiO2+2C
故选D。
考查方向
解题思路
A.2Na2O2+2H2O = 4NaOH+O2↑,固体质量增加;
B.镁粉投入FeCl3溶液中,在FeCl3溶液中存在 FeCl3+3H2O
C.铝粉与Fe2O3发生铝热反应,Fe2O3+2Al=Al2O3+2Fe,固体质量不变;
D.焦炭在电炉中还原二氧化硅,SiO2+2C
易错点
正确书写化学反应方程式。
知识点
11.下列离子方程式正确的是
正确答案
解析
A.氯化铝溶液中加入过量氨水,生成氢氧化铝白色沉淀,沉淀不溶解,错误;
B.MgSO4溶液中加入Ba(OH)2溶液,生成硫酸钡白色沉淀、氢氧化镁白色沉淀,错误;
C.硫化钠溶液显碱性,主要发生一级水解,错误;
D.NaHCO3溶液加入少量Ca(OH)2溶液,会产生碳酸钙白色沉淀、碳酸根离子,正确;故选D。
考查方向
解题思路
A.氯化铝溶液中加入过量氨水,生成氢氧化铝白色沉淀,沉淀不溶解;
B.MgSO4溶液中加入Ba(OH)2溶液,生成硫酸钡白色沉淀、氢氧化镁白色沉淀;
C.硫化钠溶液显碱性,主要发生一级水解;
D.NaHCO3溶液加入少量Ca(OH)2溶液,会产生碳酸钙白色沉淀、碳酸根离子;
易错点
NaHCO3溶液加入少量Ca(OH)2溶液,会产生碳酸钙白色沉淀、碳酸根离子
知识点
12.下列说法正确的是
正确答案
解析
A.锡、铁和电解质溶液构成原电池,铁易失电子而作负极,锡作正极,作负极的金属加速被腐蚀,所以镀层不再对铁制品起保护作用,错误;
B.用铜作电极电解稀硫酸时,阳极:Cu-2e-=Cu2+,阴极:2H+ +2e-=H2↑,总反应Cu+H2SO4 
C.某原电池的电极材料分别为Mg和Al,若电解质溶液为氢氧化钠,则Mg做正极,错误;
D.某可逆反应升高温度,活化能大的方向,活化分子百分数增加更多,化学反应速率增大程度大,错误;故选B。
考查方向
解题思路
A.锡、铁和电解质溶液构成原电池,锡作正极,作负极的金属加速被腐蚀,所以镀层不再对铁制品起保护作用;
B.用铜作电极电解稀硫酸时,阳极:Cu-2e-=Cu2+,阴极:2H+ +2e-=H2↑;
C.Mg和Al,若电解质溶液为氢氧化钠,则Mg做正极;
D.某可逆反应升高温度,活化能大的方向,活化分子百分数增加更多,化学反应速率增大程度大;
易错点
某可逆反应升高温度,活化能大的方向,活化分子百分数增加更多,化学反应速率增大程度大
知识点
23.H、C、N、O、Al、S是常见的六种元素。完成下列填空:
(1)碳元素有12C、13C和14C等同位素。在14C原子中,核外存在 对自旋相反的电子。
(2)碳在形成化合物时,其所成化学键以共价键为主,原因是 。
任选上述元素可组成多种四原子的共价化合物,请写出其中含非极性键的一种化合物的电子式
上述元素可组成盐NH4Al(SO4)2。向10 mL 1mol/L NH4Al(SO4)2溶液中滴加1mol/L的NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下。
①NH4Al(SO4)2溶液中所有离子的浓度由大到
小的顺序是( ) ,请解释阳
离子浓度差异的原因 ( )
②写出N点反应的离子方程式 ( )
③若向10 mL1mol/L NH4Al(SO4)2溶液中加入20 mL
1.2 mol/LBa(OH)2溶液,充分反应后,产生沉淀 ( )mol。
正确答案
2
解析
碳原子的基态原子电子排布式
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+、Al3+的水解能力差异、及NH4+、Al3+与OH–反应的先后顺序。
正确答案
碳有四个价电子且原子半径较小,难以通过完全得到或失去电子达到稳定结构。
解析
碳有四个价电子且原子半径较小,难以通过完全得到或失去电子达到稳定结构。
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+ 、Al3+的水解能力差异、及NH4+ 、Al3+与OH–反应的先后顺序。
正确答案
H:O:O:H或H:C︙︙ C:H
解析
四原子的共价化合物且含非极性键:如H2O2、C2H2等。
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+ 、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+、Al3+的水解能力差异、及NH4+、Al3+与OH–反应的先后顺序。
正确答案
①c(SO42-)> c(NH4+)> c(Al3+)> c(H+)> c(OH–),由于碱性:氨水>Al(OH)3,故Al3+的水解程度大于NH4+的水解程度,c(NH4+) > c(Al3+) ;溶液显酸性,是由于NH4+和Al3+水解造成的,因水解程度较小,所以c(NH4+) 、c(Al3+)远大于c(H+) 浓度。
②NH4+ +OH–→NH3∙H2O。
③0.022。
解析
①从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+可知,碱性强弱是:氨水>Al(OH)3,故Al3+的水解程度大于NH4+的水解程度,c(NH4+) > c(Al3+) ;溶液显酸性,是由于NH4+和Al3+水解造成的,因水解程度较小,所以c(NH4+) 、c(Al3+)远大于c(H+)浓度。
②N点时,不论是从图像还是NH4+ 、Al3+与OH–反应的先后顺序得到:NH4+ +OH–→NH3∙H2O。
③依据: NH4Al(SO4)2 + 2Ba(OH)2 → Al(OH)3↓+ NH3∙H2O + 2BaSO4↓
10×10-3L×1mol/L 2×10×10-3L×1mol/L 0.01mol 0.02 mol
又因:Ba(OH)2过量20×10-3×1.2 mol/L-2×10×10-3L×1mol/L=0.004 mol,
即过量n(OH-)=0.008mol.
依据Al(OH)3 + OH- = AlO2-+ 2H2O
0.008 mol 0.008 mol
最终剩余Al(OH)3的物质的量为0.01mol - 0.008 mol = 0.002 mol,
故最后所得沉淀总量是:0.02 mol+0.002 mol= 0.022 mol。
考查方向
原子结构、分子结构、盐的性质(水解等)及计算。
解题思路
从反应Al3++3NH3·H2O→Al(OH)3↓+3NH4+,理解NH4+ 、Al3+的水解能力差异(越弱越水解)、及与OH–反应的先后顺序。
易错点
NH4+、Al3+的水解能力差异、及NH4+、Al3+与OH–反应的先后顺序。
钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用。已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3。请回答下列问题:
31.在空气中加热CoCO3可得到黑色Co3O4,写出该反应的化学方程式_______________
32.Co3O4与浓盐酸反应能生成黄绿色气体,写出该反应的离子方程式______________。
33.常温下,CoCl2溶液在碱性条件下可以得到粉红色Co(OH)2沉淀。已知当溶液中某离子的浓度≤10-5mol·L-1时,就认为该离子不存在,Ksp[Co(OH)2]=1.0×10-15mol3·L-3。若要使0.1 mol·L-1CoCl2溶液中的Co2+完全沉淀,则溶液pH的控制范围为____________。
34.Co(OH)2具有较显著的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式_________
35.Co(OH)2在空气中加热时,样品质量随温度变化的曲线如下图所示,通过分析计算确定: ①1000℃时,固体的成分为_____________。②取800℃时的产物(其中Co的化合价为+2、+3),用480 mL5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。则该钴氧化物中n(Co2+) :n(Co3+)=__________。
正确答案
6CoCO3+O2 
解析
空气中加热CoCO3可得到黑色Co3O4,可见Co的化合价升高,必有元素化合价的降低做氧化剂,因此能得出该反应物为空气中的氧气,谈的元素化合价不变,因此,方程式的书写配平需考虑得失电子守恒:6CoCO3+O2 
考查方向
解题思路
准确把握住氧化还原反应的得失电子守恒、化合价升降特点。
易错点
氧化还原反应的配平、得失电子守恒原则、PH调节的KSP的计算
正确答案
Co3O4 + 8H+ + 2Cl- ==3Co2+ + Cl2↑ + 4H2O
解析
Co3O4与浓盐酸反应能生成黄绿色气体,则盐酸的Cl- =化合价升高,Co3O4的化合价必须降低:Co3O4 + 8H+ + 2Cl- ==3Co2+ + Cl2↑ + 4H2O
考查方向
解题思路
准确把握住氧化还原反应的得失电子守恒、化合价升降特点。
易错点
氧化还原反应的配平、得失电子守恒原则、PH调节的KSP的计算
正确答案
≥9
解析
根据沉淀完全时离子浓度应该低于1.0×10-5,代入Ksp[Co(OH)2]=1.0×10-15mol3·L-3进行计算可知pH≥9的控制范围为。
考查方向
解题思路
准确把握住氧化还原反应的得失电子守恒、化合价升降特点。
易错点
氧化还原反应的配平、得失电子守恒原则、PH调节的KSP的计算
正确答案
Co(OH)2+2H2O
解析
本题可以类比铝元素的氢氧化铝的电离,Co(OH)2+2H2O
考查方向
解题思路
准确把握住氧化还原反应的得失电子守恒、化合价升降特点。
易错点
氧化还原反应的配平、得失电子守恒原则、PH调节的KSP的计算
正确答案
①CoO ②3∶2
解析
从图像上得知在1000℃时,固体质量不再发生变化,此时样品已经形成为稳定的氧化物CoO,根据产生的氯气所失去的电子数,综合计算是得电子守恒可知n(Co2+) :n(Co3+)=3∶2
考查方向
解题思路
准确把握住氧化还原反应的得失电子守恒、化合价升降特点。
易错点
氧化还原反应的配平、得失电子守恒原则、PH调节的KSP的计算
10.软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为 。
(2)现代冶炼金属锰的一种工艺流程如下图所示:

下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
软锰矿还原浸出的反应为:
12MnO2 + C6H12O6 + 12H2SO4=12MnSO4 + CO2↑+18H2O
①该反应中,还原剂为_______。写出一种能提高还原浸出速率的措施: 。
②滤液1的pH (填“>”、“<”或“=”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3往MnSO4溶液中加入过量NH4HCO3溶液,,该反应的离子方程式为_________________________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s) + 2OH-(aq) 
正确答案
(1)8Al + 3Mn3O4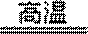
(2)①C6H12O6 升高反应温度(或将软锰矿研细等其他合理答案)②>③Ca2+(3)Mn2+ + 2HCO3-=MnCO3↓+ H2O + CO2↑ 100
解析
(1)高温下,Al和Mn3O4发生铝热反应生成Mn,根据反应物、生成物及反应条件书写方程式为8Al + 3Mn3O4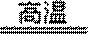
(2)软锰矿还原浸出得到硫酸锰溶液,说明浸取液为稀硫酸,同时溶液中还含有Ca2+、Fe3+、Cu2+等杂质,调节溶液的pH,Fe(OH)3的PKsp为37.4与其它离子相比最大,调节pH可以将 Fe(OH)3沉淀下来,向滤液中加入硫化铵,CuS的pKsp为35.2,可以将铜离子形成硫化物沉淀下来,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后对得到的含有锰离子的盐电解,可以得到金属锰,
①软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4═12MnSO4+6CO2↑+18H2O,该反应中,Mn元素化合价由+4价变为+2价、C元素化合价由0价变为+4价,失电子化合价升高的反应物是还原剂,所以C6H12O6为还原剂;反应物接触面积越大、温度越高反应速率越快,所以能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等;
②软锰矿还原浸出的反应为:12MnO2+ C6H12O6+12H2SO4=12MnSO4+CO2↑+18H2O,溶液呈强酸性,还原浸出液中含有Mn2+、Ca2+、Fe3+、Cu2+,此时未形成沉淀, pKsp=-1gKsp,pKsp越大,沉淀溶解平衡常数越小,滤液1为形成Fe(OH)3沉淀,pKsp=-1gKsp=37.4,Ksp=10-37.4,Ksp=c(Fe3+)×c3(OH-)=10-37.4,c(OH-)≈10-10,c(H+)=1×10-4mol/L,pH=4,所以滤液1的pH大于MnSO4浸出液的pH=4才能形成氢氧化铁沉淀,故答案为:>;
③CaF2难溶于水,滤液2中含有Mn2+、Ca2+、NH4+、SO42-,加入MnF2的目的是形成CaF2沉淀,除去Ca2+;
(3)锰离子和碳酸氢根离子反应生成碳酸锰沉淀、水和二氧化碳气体,离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;
由MnCO3(s) + 2OH-(aq)
K=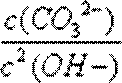


考查方向
本题主要考查化工流程、氧化还原反应、合金及其他金属难溶电解质的溶解平衡等相关知识。
解题思路
学会找关键词、关键数据、关键反应等题供的重要信息。把每一个流程分析透彻是得分的关键。比如该题流程中的调节PH的目的是将铁离子和铜离子转化成氢氧化物沉淀;加入MnF2,形成CaF2沉淀,除去Ca2+等。
易错点
审题不清、甚至题目都没看懂;每一步骤发生的反应及其变化分析不清。
知识点
10.钼(Mo)是一种过渡金属元素,通常用作合金及不镑钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备 金属钼的主要流程图,已知钼酸难溶于水。








正确答案
(1)2MoS2+7O2
(2)MoO3+2NH3·H2O=(NH4)2MoO4↓+2H2O
(3)CD 2CO32-+SO2+H2O=2HCO3-+SO32-
(4)烧杯、漏斗、玻璃棒
(5)41.1
解析
(1)二硫化钼与氧气在高温下反应生成三氧化钼和二氧化硫,所以反应方程式为:2MoS2+7O2
(2)由流程中信息可知MoO3是酸性氧化物,与NH3·H2O反应生成难溶性盐和水,所以反应方程式为:MoO3+2NH3·H2O=(NH4)2MoO4↓+2H2O;
(3)由于酸性H2SO3大于H2CO3、所以H2SO3可以与HCO



(4)操作1和操作2都是分离固体与液体混合物,都是过滤操作,所以需要的仪器有烧杯、漏斗、玻璃棒;
(5)根据反应方程式知,1 mol甲烷完全反应生成4 mol还原性气体,而:3CO+MoO3

考查方向
以化工生产中制备金属钼的流程图为载体,考查化学方程式、离子方程式的书写以及离子的共存的判断;通过实验基本操作考查实验仪器的使用,利用守恒法和关系式法进行简计算。
解题思路
(1)二硫化钼与氧气在高温下反应生成三氧化钼和二氧化硫。
(2)由流程中信息可知MoO3是酸性氧化物,与NH3·H2O反应生成难溶性盐和水;
(3)由于酸性H2SO3大于H2CO3、所以H2SO3可以与HCO



(4)操作1和操作2都是分离固体与液体混合物,都是过滤操作。
(5)根据反应方程式知,1 mol甲烷完全反应生成4 mol还原性气体,而:

易错点
(1)不注意对方程式配平;(2)没有捕捉图中信息,(NH4)2MoO4是沉淀,漏写沉淀符号;(3)没有理解弱酸的平衡常数与酸性强弱的关系致错,由于通人少量二氧化硫,所以只能完成亚硫酸的第一步电离过程;(4)不了解操作1和操作2的分离实质;(5)不能利用守恒法和关系式法进行简计算
知识点
20.已知:Ksp(CuS)=1.3×10-36mol2/L2,Ksp(MnS)=2.6×10-13mol2/L2。工业生产中常用MnS作为沉淀剂,除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),下列说法错误的是
正确答案
解析
A.MnS是固体,所以增大使用量,平衡不移动,因此MnS使用量越大,不能增大废水中的Cu2+的去除率,A错误;B.当废水中的Cu2+浓度小于10-5时,就可以看作沉淀完全,B正确;C.往平衡体系中加入少量CuSO4固体后,溶液中铜离子浓度增大,平衡正向移动,所以c(Mn2+)变大,C正确。D.该反应的平衡常数K=


考查方向
解题思路
A.MnS是固体,所以增大使用量,平衡不移动。B.当废水中的Cu2+浓度小于10-5时,就可以认为沉淀完全,C.往平衡体系中加入少量CuSO4固体后,溶液中铜离子浓度增大,平衡正向移动,所以c(Mn2+)变大。D.该反应的平衡常数K=


易错点
固体的浓度是一个常数.改变固体或纯液体的量不会影响化学平衡、当废水中的Cu2+浓度小于10-5时,就可以认为沉淀完全。
知识点
17.硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体。硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣。
(1)实验室常用FeS固体与酸反应制取H2S。已知l0℃时,FeSO4· 7H2O的溶解度是20.5g,FeCl2·4H2O的溶解度是64.5g。从氧化还原反应、平衡移动和产品纯度等角度分析,实验室制取H2S时最好选用的酸是_____(填字母)。
a.浓硫酸
b.盐酸
c.稀硫酸
d.稀硝酸
实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置可选用的是______(填序号)。
(2)硫化亚铁煅烧得到的烧渣的主要成分为FeO、Fe3O4和Fe2O3等。利用该烧渣制备铁红和副产品无氯钾肥的流程如下:
已知四种盐的溶解度随温度变化的曲线如右图所示。请回答下列问题:
①检验加入铁粉过滤后的滤液中是否含有Fe3+的方法是__________。该滤液加入NH4HCO3发生反应的离子方程式是________________。
②(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为______、_____、洗涤、干燥等;反应的化学方程式为_______________。
③实验室煅烧FeCO3(s)的操作中需要的仪器除了三脚架、泥三角、酒精灯,还需要_________________________。
(3)FeS煅烧后生成的SO2通入下列装置:
该实验的目的是_______。若将SO2通入水中制成饱和溶液,请设计实验证明亚硫酸是弱电解质。实验方案__________。(提供的药品及仪器:蒸馏水、0.1 mol·L-1的NaOH溶液;pH计,其他仪器自选)
正确答案
(1)c;bc;
(2)①向过滤后的滤液中加入硫氰化钾(KSCN)若溶液变血红色,证明含有铁离子(Fe3+),否则无铁离子(Fe3+);2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O;
②蒸发结晶、热过滤;(NH4)2SO4+2KCl=K2SO4↓+2NH4Cl;
③玻璃棒、坩埚、坩埚钳;
(3)比较亚硫酸和碳酸的酸性强弱;
解析
(1)实验室常用FeS固体与酸反应制取H2S,浓硫酸和稀硝酸有强烈的氧化性,硫化氢有还原性,a、d不选,盐酸有挥发性,使得制得的硫化氢气体不纯净,且FeSO4· 7H2O的溶解度较小,有利于平衡正向移动,故选c;
实验室制取H2S时,属于固液不加热,发生装置bc;
(2)①检验加入铁粉过滤后的滤液中是否含有Fe3+的方法是:向过滤后的滤液中加入硫氰化钾(KSCN)若溶液变血红色,证明含有铁离子(Fe3+),否则无铁离子(Fe3+);该滤液加入NH4HCO3,反应生成碳酸亚铁、二氧化碳和水,发生反应的离子方程式是2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O;
②硫酸钾的溶解度相对其他几种物质较小,蒸发后首先结晶析出,因此(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为蒸发结晶,热过滤洗涤、干燥等;反应的化学方程式为(NH4)2SO4+2KCl=K2SO4↓+2NH4Cl;
③实验室煅烧FeCO3(s)的操作中需要的仪器除了三脚架、泥三角、酒精灯,还需要玻璃棒、坩埚、坩埚钳;
(3)该实验的目的是比较亚硫酸和碳酸的酸性强弱;若将SO2通入水中制成饱和溶液,请设计实验证明亚硫酸是弱电解质。实验方案__________。(提供的药品及仪器:蒸馏水、0.1 mol·L-1的NaOH溶液;pH计,其他仪器自选)
考查方向
解题思路
使学生对发生装置、收集装置、尾气处理装置的选择条件有个更好的理解,同时让学生掌握实验方案的设计。
易错点
实验方案的设计
知识点
扫码查看完整答案与解析