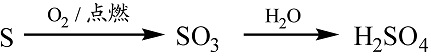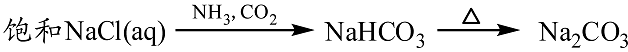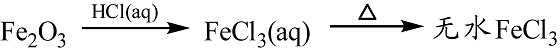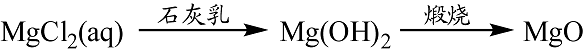- 金属及其化合物
- 共561题
17. 草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一。有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:____________。
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列说法正确的是_________(填字母序号)。
a.0.1 mol·L-1KHC2O4溶液中:c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b.0.1 mol·L-1 KHC2O4溶液中:c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c浓度均为0.1 mol·L-1 KHC2O4和K2C2O4的混合溶液中:
2c(K+) = c(HC2O4-) + c(C2O42-)
d.0.1 mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+) > c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
已知:i. pH>4时,Fe2+易被氧气氧化
ii. 几种物质的溶解度(g /100g H2O)如下
①用稀硫酸调溶液pH至1~2的目的是:___________,__________。
②趁热过滤的原因是:__________。
③氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取a g草酸亚铁晶体溶于稀硫酸中,用b mol·L-1的高锰酸钾标准液滴定,到达滴定终点时,消耗高锰酸钾VmL,则M =__________。(已知:部分反应产物为Mn2+、Fe3+、CO2)
正确答案
(1)由于CaC2O4(s)存在沉淀溶解平衡,所以EDTA在一定条件下可以有效溶解结石,一定是降低了Ca2+浓度减小,导致移动,结石溶解。
(2)abd
(3)① 抑制Fe2+ 和NH4+ 的水解 ,防止Fe2+被氧化
② 由溶解度表数据可知,趁热过滤的原因是防止低温时FeSO4·7H2O和(NH4)2SO4析出,影响FeSO4·(NH4)2SO4·6H2O的纯度。[不写(NH4)2SO4不扣分]
③ 600a/bV g·mol-1
解析
(1)CaC2O4(s)存在沉淀溶解平衡CaC2O4(s) 
(2)任何溶液都有遵循电中性原则,即溶液中所有阳离子所带的正电荷总数一定等于阴离子所带的负电荷总数,所以KHC2O4溶液中存在电荷守恒关系,正确a。由于水解,c(K+) > c(HC2O4-) ,同时由于草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度,则c(C2O42-)>c(H2C2O4)b正确;浓度均为0.1 mol·L-1 KHC2O4和K2C2O4的混合溶液中:C元素存在三种离子:C2O42-、HC2O4-、H2C2O4,所以c错误; 若将0.1 mol/L KHC2O4溶液中滴加等浓度,等体积的NaOH溶液完全反应,恰好得到K2C2O4和Na2C2O4混合溶液,而K2C2O4和Na2C2O4混合溶液呈碱性,若要得到中性溶液,则加入的NaOH溶液体积要小于KHC2O4溶液则:c(K+) > c(Na+);d正确;所以选abd;
(3)①由于Fe2+ 和NH4+ 的水解会影响最终的产品纯度,所以要调节pH抑制Fe2+ 和NH4+ 的水解,同时Fe2+在碱性条件下容易被氧化为Fe3+,同样可以影响产品的纯度防止Fe2+被氧化,
②由溶解度表数据可知,温度过低,(NH4)2SO4、FeSO4·7H2O的溶解度降低,所以会有晶体析出,影响FeSO4·(NH4)2SO4·6H2O的纯度,所以趁热过滤的原因是防止低温时FeSO4·7H2O和(NH4)2SO4析出,进而影响产品纯度;
③由题给信息:“部分反应产物为Mn2+、Fe3+、CO2”可知FeC2O4被高锰酸钾氧化为Fe3+和CO2,表明FeC2O4具有还原性,将KMnO4还有为Mn2+,分析有关元素化合价的变化可知,反应过程中1 mol FeC2O4·2H2O可失去3 mol电子,而l mol KMnO4可得到5 mol电子:根据得失电子数相等的原则,反应中FeC2O4·2H2O与KMnO4的物质的量之比为5:3。因此,若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为3/5 mol。 则可以计算出草酸亚铁晶体的摩尔质量(M)=600a/bV g·mol-1
考查方向
以草酸及其化合物为载体,考查难溶电解质的溶解平衡、离子浓度大小关系及守恒关系;以流程图考查草酸亚铁晶体制备过程中的实验原理和操作要求及氧化还原滴定原理和计算。
解题思路
(1)由于CaC2O4(s)存在沉淀溶解平衡,所以EDTA在一定条件下可以有效溶解结石,一
定是降低了Ca2+浓度减小,导致移动,结石溶解。
(2)任何溶液都有遵循电中性原则,即溶液中所有阳离子所带的正电荷总数一定等于阴离子所带的负电荷总数,所以KHC2O4溶液中存在电荷守恒关系,正确a。由于水解,c(K+) > c(HC2O4-) ,同时由于草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度,则c(C2O42-)>c(H2C2O4)b正确;浓度均为0.1 mol·L-1 KHC2O4和K2C2O4的混合溶液中:C元素存在三种离子:C2O42-、HC2O4-、H2C2O4,所以c错误; 若将0.1 mol/L KHC2O4溶液中滴加等浓度,等体积的NaOH溶液完全反应,恰好得到K2C2O4和Na2C2O4混合溶液,而K2C2O4和Na2C2O4混合溶液呈碱性,若要得到中性溶液,则加入的NaOH溶液体积要小于KHC2O4溶液则:c(K+) > c(Na+);d正确;
(3)①由于Fe2+ 和NH4+ 的水解会影响最终的产品纯度,所以要调节pH抑制Fe2+ 和NH4+ 的水解,同时Fe2+在碱性条件下容易被氧化为Fe3+,同样可以影响产品的纯度防止Fe2+被氧化;
②由溶解度表数据可知,温度过低,(NH4)2SO4、FeSO4·7H2O的溶解度降低,所以会有晶体析出,影响FeSO4·(NH4)2SO4·6H2O的纯度;
③由题给信息:“部分反应产物为Mn2+、Fe3+、CO2”可知FeC2O4被高锰酸钾氧化为Fe3+和CO2,表明FeC2O4具有还原性,将KMnO4还有为Mn2+。分析有关元素化合价的变化可知,反应过程中1 mol FeC2O4·2H2O可失去3 mol电子,而l mol KMnO4可得到5 mol电子:根据得失电子数相等的原则,反应中FeC2O4·2H2O与KMnO4的物质的量之比为5:3。因此,若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为3/5 mol。则可以计算出草酸亚铁晶体的摩尔质量(M)=600a/bV g·mol-1
易错点
影响对沉淀溶解平衡的原理理解不准确,不能正确应用化学平衡原理解释原因;离子浓度大小关系及守恒关系不熟练,不能灵活应用;对题中信息不能有效提取和整合;
知识点
7.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是( )
正确答案
解析
加入氢氧化钠,因含有铁离子,可生成红褐色沉淀,不能检验是否含有亚铁离子,故A错误;
亚铁离子具有还原性,可与高锰酸钾等发生氧化还原反应,高锰酸钾溶液褪色,可鉴别,故B正确;
亚铁离子加入KSCN无明显现象,不能鉴别,KSCN只能鉴别铁离子,故C错误;
亚铁离子与苯酚不反应,不能鉴别,只能鉴别铁离子,故D错误.
故选B.
考查方向
解题思路
亚铁离子具有还原性,可与氯水、高锰酸钾等氧化剂反应,以此解答该题.
易错点
本题考查物质的检验,为高频考点,题目难度不大,本题注意亚铁离子与铁离子性质的区别,检验时必须有明显不同的现象.
知识点
18.往含Fe3+、H+、NO3-的混合液中加入少量含SO32-的某溶液充分反应后(设溶液中的其他成分不反应),下列表示该混合溶液中发生反应的离子方程式中正确的是( )
正确答案
解析
每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个,该小题不给分
知识点
9.能正确表示下列反应离子方程式的是:
正确答案
解析
A.电荷不守恒。B.碳酸氢根不可以再拆。D.漂白液的有效成分是NaClO。
考查方向
解题思路
根据离子方式的书写规则,先写出正确的化学方程式,在溶液中可以完全电离的写成离子的形式,把没有参加反应的离子如数抵消,最后检查电荷数是否守恒元素是否守恒。
易错点
1、元素守恒,电荷守恒的应用;
2、哪些物质可以拆成离子的形式会忘记。
知识点
4.下列实验“操作和现象”与“结论”对应关系正确的是()
正确答案
D
解析
A、产生红棕色气体是因为加入了硫酸后溶液中就有了硝酸,硝酸与亚铁离子发生反应,硝酸被还原为一氧化氮,一氧化氮与氧气结合生成了红棕色的二氧化氮的缘故;
B、葡萄糖与新制氢氧化铜浊液的反应是在碱性的环境下,淀粉水解后没中和原来的硫酸,导致没有红色沉淀产生;
C、乙醇与浓硫酸混合加热产生的气体除乙烯外还可能产生二氧化硫,二氧化硫也能使酸性高锰酸钾溶液褪色,所以使溶液褪色的不一定是乙烯。
D、硅酸钠的酸性度小于碳酸,所以向饱和的碳酸钠溶液中通二氧化碳产生析出硅酸沉淀。
考查方向
解题思路
A、加入了硫酸后溶液中就有了硝酸;
B、葡萄糖与新制氢氧化铜浊液的反应是在碱性的环境下;
C、乙醇与浓硫酸混合加热产生的气体除乙烯外还可能产生二氧化硫;
D、硅酸钠的酸性度小于碳酸。
易错点
1.硝酸的强氧化性;
2. 醛基被氧化的环境。
知识点
14.有资料介绍Fe3+在水溶液中通常以水合离子形式存在,[Fe(H2O)6]3+几乎无色。某化学实验小组对实验室Fe(NO3)3和FeCl3溶液呈黄色的原因产生了疑问,进一步查阅资料发现:
①[Fe(H2O)6]3++H2O
②[FeCl4(H2O)2]-为黄色。[来源:学科网ZXXK]
他们进行了如下探究实验。请回答下列问题:
【实验I】
(1)你认为Fe(NO3)3溶液呈黄色的原因是__________________________________。
(2)你认为FeCl3溶液呈黄色主要是含有_________微粒,理由:_________________。
【实验II】
已知透光率越大,溶液颜色越浅。用色度计分别测定0.5mol·L-1 Fe(NO3)3和FeCl3溶液在不同温度下的透光率如下图所示。
(3)随着温度升高,Fe(NO3)3溶液透光率逐渐减小的原因是____________________。
(4)FeCl3溶液透光率随温度升高而减小的幅度明显
大于Fe(NO3)3溶液,其原因用离子方程式表示:______________________,该反应属于________反应(填“放热”或“吸热”)。
【实验Ⅲ】
该实验小组同学还设计了一个实验方案验证(4)中结论。
(5)取试管②中无色溶液,滴加几滴________(从下列选项中选择最佳试剂,填写字母序号),通过现象能证明(4)中结论正确。
正确答案
(1).[Fe(H2O)6]3+水解产生了[Fe(H2O)6-n(OH)n]3-n
(2).[FeCl4(H2O)2]-;试管②、④中加入等量的HNO3后,②中溶液褪色,而④中溶液仍呈黄色
(3).温度升高,导致平衡[Fe(H2O)6]3++ nH2O 
(4). [Fe(H2O)6]3++ 4Cl- 
(5).B
解析
(1).因为①[Fe(H2O)6]3++H2O
(2).试管②、④中加入等量的HNO3后,②中溶液褪色,而④中溶液仍呈黄色,FeCl3溶液呈黄色主要是含有[FeCl4(H2O)2]-;
(3).温度升高,导致平衡[Fe(H2O)6]3++ nH2O 
(4).FeCl3溶液透光率随温度升高而减小的幅度明显大于Fe(NO3)3溶液,原因是[Fe(H2O)6]3+结合Cl-生成[FeCl4(H2O)2]-,用离子方程式表示:[Fe(H2O)6]3++ 4Cl- 
(5).取试管②中无色溶液,滴加几滴含有氯离子的溶液,同时排除三价铁离子的影响,验证(4)中结论正确,故选B。
考查方向
解题思路
(1).因为①[Fe(H2O)6]3++H2O
(2).试管②、④中加入等量的HNO3后,②中溶液褪色,而④中溶液仍呈黄色,FeCl3溶液呈黄色主要是含有[FeCl4(H2O)2]-;
(3).温度升高,导致平衡[Fe(H2O)6]3++ nH2O 
(4).FeCl3溶液透光率随温度升高而减小的幅度明显大于Fe(NO3)3溶液,原因是[Fe(H2O)6]3+结合Cl-生成[FeCl4(H2O)2]-,用离子方程式表示:[Fe(H2O)6]3++ 4Cl- 
(5).取试管②中无色溶液,滴加几滴含有氯离子的溶液,同时排除三价铁离子的影响。
易错点
根据实验所提供资料的分析,正确理解实验的目的及出现现象的原因,对于解答此新知识的探究型问题是尤其重要的。
知识点
下列物质转化在给定条件下能实现的是
①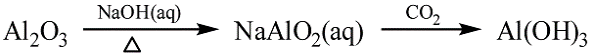
③
④
⑤
正确答案
解析
略
知识点
为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
请回答:(1)稀硝酸和Cu反应的化学方程式为_________。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方案:_________。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
①据实验现象写出发生反应的离子方程式:_________。
②导致实验过程中溶液pH略有上升的可能原因是_________。
③解释乙同学的实验现象
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:_________。
正确答案
见解析。
解析
(1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(2)测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应。
(3)①Cu + 2Fe3+ = Cu2+ + 2Fe2+
②Fe3+ 变为Cu2+和Fe2+,水解能力下降
③在此酸性条件下NO3-不能氧化Cu。
(4)将铜片放入0.5mol/L氯化铁溶液中
知识点
化学与生活密切相关,下列说法不正确的是
正确答案
解析
略
知识点
建筑用的红砖和青砖,其颜色是由其中含有的不同价态的铁氧化物所致。我国古代砖瓦建筑能够保持到现在的,几乎无一例外的是由青砖建成。有人提出以下可能的原因:
①青砖中含的是FeO;②青砖中含的是Fe3O4;③Fe2O3遇长期酸雨侵蚀会风化溶解使砖瓦强度降低;④Fe3O4性质稳定;⑤FeO性质稳定。你认为有道理的是
正确答案
解析
略
知识点
扫码查看完整答案与解析