- 金属及其化合物
- 共561题
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
已知:3NO3-+ 8Al + 5OH- + 2H2O
根据以上的实验操作与现象,该同学得出的结论不正确的是
正确答案
解析
略
知识点
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: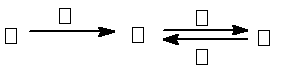
正确答案
解析
略
知识点
物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。
请回答下列问题:
(1)写出下列物质的化学式:B 、E 、G ;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是 ,阴极物质是 ,电解质溶液是 ;
(3)反应②的化学方程式是 ;
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,和到0.12molD,则反应的平衡常数 。
若温度不变,再中入0.50mol氧气后重新达到平衡,则B的平衡浓度 (填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),D的体积分数 (填“增大”、“不变”或“减小”)。
正确答案
(1)

(2)粗铜 精铜 
(3)
(4)23.8
解析
(1)此题的G为题眼,因G为砖红色沉淀,显然是Cu2O,则F为铜的化合物,再结合“单质C可与E的浓溶液发生反应生成B和F”,而B与O2反应生成D,D溶于水生成E,,可得出B为SO2,D为SO3,E为H2SO4,C为Cu(由“A为某金属矿的主要成分”的信息可以得到证实),故F为CuSO4。
(2)该问考查的是铜的电解精炼的知识,在铜的电解精炼中,应用粗铜作阳极,精铜作阴极,CuSO4溶液为电解质溶液。
(3)反应②的化学方程式是Cu+2H2SO4(浓) DCuSO4+SO2+2H2O。
(4)此问考查的是平衡常数的计算,是一道化学平衡的常规计算题。根据题给条件,经计算分别列出各物质的起始量、变化量和平衡量,可表示如下:
2SO2 + O2 
起始浓度(mol/L) 0.23 0.11 0
浓度变化(mol/L) 0.12 0.06 0.12
平衡浓度(mol/L) 0.11 0.05 0.12
故该反应的化学平衡常数K=(0.12 mol/L)2/[(0.11mol/L)2·(0.05 mol/L)]= 23.8 L /mol。
若温度不变,再加入0.50 mol O2后重新达到平衡,因为平衡要向右移动,所以SO2的平衡浓度要减小,即B的平衡浓度减小;氧气的转化率降低;根据勒夏特列原理,SO3的体积分数减小。
知识点
9.为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响判断正确的是( )
正确答案
解析
略
知识点
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
①反应C+G
②I是一种常见的温室气体,它和E可以发生反应:2E+I
为60%。
回答问题:
(1)①中反应的化学方程式为__________;
(2)化合物I的电子式为__________,它的空间结构是__________;
(3)1。6g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少需铜粉的质量(写出粒子方程式和计算过程);
(4)C与过量NaOH溶液反应的离子方程式为__________;
(5)E在I中燃烧观察到的现象是__________。
正确答案
(1)Al+ Fe2O3
(2)
(3)2Fe3++Cu=2 Fe2++ Cu2+ n(Fe2O3)=0.01mol,依据离子方程式,则n(Cu )= 0.01mol,m(Cu )=0.64g。
(4)2 Al + 2OH- + 2 H2O=2AlO2- + 3H2↑ AlO2- + CO2 + 2H2O = Al(OH)3↓+ HCO3-
(5)剧烈燃烧,放出热量,生成黑色固体和白色固体。
解析
该题有多处“题眼”。依据题目信息C、B是单质,G、H是二元化合物,
知识点
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
正确答案
(1)A :NH3·H2O或NH3 ;E :H2SO4 F : AgNO3 C : BaCl2
(2)B Na2CO3或K2CO3 用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
D Al2(SO4)3或MgSO4 取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液
解析
(1)由题干表述可知A和E不是盐,又由纯E为无色油状液体,推知E为硫酸(③步操作进一步确定);
由题干和①步操作可知A为氨水;
再由②步操作可知F中阳离子为Ag+发生的反应为:Ag++NH3·H2O=AgOH↓+NH4+;AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O;而常见的盐中只有AgNO3可溶于水,故F为AgNO3;
由③步操作可知B中阴离子应为CO32-,由于此无色无味的气体只能是CO2, B、C、D中能生成沉淀说明不能是HCO3-,而阳离子可是常见的K+、Na+、NH4+等待定
同样由②步操作D中能与氨水生成沉淀的无色溶液中常见的为阳离子为Mg2+或Al3+,而阴离子需待下步反应再确定;
由④步操作生成的沉淀为可能为AgCl、AgBr、AgI、BaSO4、H2SiO3(不合理)等,但限于题干所述中学常用试剂,则沉淀应为AgCl和BaSO4,才不溶于HNO3,一个是与AgNO3结合生成的沉淀,一个是与硫酸结合形成的沉淀,故C应该同时含有Ba2+和Cl-即,C为BaCl2,进而推出D中阴离子应该为SO42-,因为题干所述盐溶液中阴离子均不同,故D为Al2(SO4)3或MgSO4其他解析见答案
知识点
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是____________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为________;Ⅳ中发生反应的化学方程式为_________;Ⅴ中的试剂为________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ-Ⅲ-Ⅳ-Ⅱ-Ⅴ-Ⅵ,此时Ⅱ中现象为________,原因是______________。
(4)经上述反应,2.5 g化合物A理论上可得0.56 L(标准状况)M,则A的化学式为________。
正确答案
(1)分液漏斗
(2)碱石灰 3CuO+2NH33Cu+N2+3H2O 浓H2SO4
(3)试纸变蓝 CuO与氨气反应生成的水和未反应的氨气形成氨水,使试纸变蓝
(4)Mg3N2
解析
本题考查氨气的性质实验,探究氨气的还原性及氨水的碱性等,仪器B的名称为分液漏斗;Ⅱ中红色石蕊试纸变蓝说明化合物A与水反应生成了氨气,氨气具有还原性,将氨气通过碱石灰干燥后,与灼热的氧化铜反应生成铜、氮气和水,用浓硫酸吸收尾气中的氨气(同时浓硫酸可防止水蒸气进入Ⅳ中),最后用排水法收集氮气。n(N2)==0.025 mol,m(N)=0.025 mol×28 g/mol=0.7 g,A中N%=×100%=28%,结合短周期元素形成的氮化物,其中氮的百分含量为28%的只有Mg3N2,可确定A为Mg3N2。
知识点
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
(2)镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式。
(3)硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 。
长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。利用上述方法可制取Ba的主要原因是 。
A.高温时Al的活泼性大于Ba
B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定
D.Ba的沸点比Al的低
正确答案
(1)4,13。
(2)
(3)
(4)弱,d
解析
(1)铝原子核外电子云有s、p,分别有1、3种伸展方向,其核外有13个电子,则有13种不同运动状态;
(2)类似氯化铝与氢氧化钠溶液反应;
(3)根据不同类长石其氧原子的物质的量分数相同,结合化合价代数和是0可写出钙长石的化学式;
(4)该反应是利用Ba的沸点比Al的低,Ba气化逸出,使平衡右移。
知识点
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
回答下列问题:
(1)加入过量废铁屑的目的是 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的____(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是 。
(3)反应Ⅱ的离子方程式为 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
正确答案
(1)使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+
(2)Al3+ ; 加快反应速率(或使反应物充分接触)
(3)Fe2+ + NO2- + 2H+ = Fe3+ + NO↑ + H2O ;氧化剂; 2 mol
(4)2Fe(OH)2++2H2O
解析
略
知识点
9.一定条件下A、B、C的如下图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )
①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
正确答案
解析
①铁与氯气反应生成氯化铁,不存在途中转化关系,故错误
②氧气不足时,碳与氧气反应生成CO,氧气充足时,碳与氧气反应生成CO2,转化关系与图中相同,正确
③氯化铝与少量氢氧化钠反应生成氢氧化铝,与过来那个氢氧化钠反应生成偏铝酸钠,转化关系与图中相同,正确
④氢氧化钠与CO2反应生成碳酸钠,与过量CO2反应生成碳酸氢钠,转化关系与图中相同,正确
⑤S与O2反应不成生成SO3,不符合转化关系,错误
⑥碳酸钠与盐酸反应生成碳酸氢钠,碳酸氢钠与盐酸反应生成CO2,碳酸钠与盐酸反应生成CO2,转化关系与图中相同,正确
故本题选择A
考查方向
解题思路
由图可知,图示既是盖斯定律的应用,也是物质之间的相互转化,符合转化关系的有变价物质的氧化反应、两性物质的转化以及多元酸对应的盐类之间的额反应等,依次进行分析
易错点
元素及其化合物之间的关系不明确
知识点
扫码查看完整答案与解析










