- 金属及其化合物
- 共561题
损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
8.钠、钾着火,下列可用来灭火的是_____(填字母)。
9.NaCN是属于________(填“离子化合物”或“共价化合物”),NaCN的电子式为:_________。
10.白磷有毒,能和氯酸溶液发生氧化还原反应:3P4 + 10HClO3 + 18H2O = 10HCl + 12H3PO4,该反应的氧化剂是_________,氧化产物是_________,若有1mol P4参加反应转移电子为 _________mol。
11.NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,
可能发生氧化还原反应,请写出发生非氧化还原反应的热分解方程式_________。
12.NaCN属于剧毒物质,有多种无害化处理方法,H2O2处理法是其中之一:NaCN + H2O2→N2↑+ X + H2O,推测X的化学式为_________。
正确答案
解析
钠、钾着火,因其又易与水剧烈反应等,故不能用含有水(A.B.)或生成水(C.)的物质灭火,则可用来灭火的只有D。
考查方向
解题思路
依据无机物的性质、氧化还原反应的规律等解题。
易错点
氰化钠的性质与结构(如电子式)等。
正确答案
离子化合物 ; 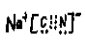
解析
NaCN是属于 “离子化合物”,NaCN的电子式为: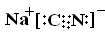
考查方向
解题思路
依据无机物的性质、氧化还原反应的规律等解题。
易错点
氰化钠的性质与结构(如电子式)等。
正确答案
HClO3; H3PO4;20。
解析
白磷有毒,能和氯酸溶液发生氧化还原反应:3P4 + 10HClO3 + 18H2O = 10HCl + 12H3PO4,该反应的氧化剂是HClO3(得到电子、化合价降低的反应物),氧化产物是H3PO4(失去电子、化合价升高的产物),若有1mol P4参加反应转移电子为4×5=20 mol。
考查方向
解题思路
依据无机物的性质、氧化还原反应的规律等解题。
易错点
氰化钠的性质与结构(如电子式)等。
正确答案
NH4NO3 = NH3↑+HNO3
解析
NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,
其发生非氧化还原反应的热分解方程式NH4NO3 = NH3↑+HNO3 。
考查方向
解题思路
依据无机物的性质、氧化还原反应的规律等解题。
易错点
氰化钠的性质与结构(如电子式)等。
正确答案
NaHCO3。
解析
NaCN属于剧毒物质,有多种无害化处理方法,H2O2处理法是其中之一:NaCN + H2O2→N2↑+ X + H2O,依据质量守恒定律及氧化还原反应规律,推测X的化学式为NaHCO3。
考查方向
解题思路
依据无机物的性质、氧化还原反应的规律等解题。
易错点
氰化钠的性质与结构(如电子式)等。
2.对中国古代著作涉及化学的叙述,下列解说错误的是()
正确答案
解析
“凡石灰,经火焚炼为用”里的“石灰”指的是CaCO3,不是Ca(OH)2,如果是Ca(OH)2在古代就可以直接拿来用了,不用焚烧。其中A、B、C的说法都是对的。所以本题选D
考查方向
解题思路
“凡石灰,经火焚炼为用”里的“石灰”指的是CaCO3,不是Ca(OH)2.
易错点
对文言文理解出现失误,也没有更好的结合现在的生活中的经验去判断出所提出的物质分别是哪类物质。
知识点
6.下列说法正确的是( )
正确答案
解析
A、硫化氢具有还原性,三价铁具有氧化性,二者会发生反应:2Fe3++H2S=2Fe2++S↓+2H+,离子反应遵循电荷守恒,故A错误;
Al3+、HCO3-相互促进水解,不能共存,故B错误;
C、Na2C2O4溶液,草酸根水解,溶液是碱性的,c(OH-)>c(H+)。 Na+是最多的,不水解,C2O4-次之,OH-浓度小于C2O42-,因为水解是少量的,OH-浓度大于HC2O4-的浓度,因为OH-来自于C2O42-的水解与水的电离,HC2O4-只来自于草酸根的水解。 H+的浓度最小,所以是c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+),故C错误;
D、根据盐类水解规律:越弱越水解、谁强显谁性,25℃时NH4CN水溶液显碱性,所以25℃时的电离常数K(NH3·H2O)>K(HCN),故D正确。
考查方向
解题思路
根据题目相关信息判断反应发生情况。
易错点
离子共存问题、水解电离、三种平衡
知识点
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如下图所示:
已知:FeTiO3与盐酸反应的离子方程式为:
FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
24.化合物FeTiO3中铁元素的化合价是 。
25.滤渣A的成分是 。
26.滤液B中TiOCl42-转化生成TiO2的离子方程式为 。
27.反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是 。
28.写出由滤液D生成FePO4的离子方程式 。
29.由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
正确答案
+2
解析
反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O中,不是非氧化还原反应,可以判断铁元素化合价为+2价,故答案为:+2;
考查方向
解题思路
根据反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,不是非氧化还原反应,可以判断铁元素化合价为+2价;
易错点
元素及其化合物的性质、离子方程式书写、化学计算
正确答案
SiO2
解析
由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,故答案为:SiO2;
考查方向
解题思路
MgO、CaO、SiO2等杂质中,二氧化硅不溶于稀盐酸,成为滤渣A;
易错点
元素及其化合物的性质、离子方程式书写、化学计算
正确答案
TiOCl42-+H2O△TiO2↓+2H++4Cl-
解析
根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O=TiO2↓+2H++4Cl-,
故答案为:TiOCl42-+H2O=TiO2↓+2H++4Cl-;
考查方向
解题思路
根据流程图示,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀;
易错点
元素及其化合物的性质、离子方程式书写、化学计算
正确答案
温度过高时,反应物氨水(或双氧水)会受热分解
解析
由于二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解,所以反应温度过高时,Ti元素浸出率下降,
故答案为:温度过高时,反应物氨水(或双氧水)受热易分解;
考查方向
解题思路
二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15,温度过高,双氧水和氨水都容易分解;
易错点
元素及其化合物的性质、离子方程式书写、化学计算
正确答案
2Fe2+ + 2H3PO4 + H2O2 
解析
根据流程图示可知,滤液D是FeCl2 溶液,加入双氧水和磷酸过滤可得沉淀FePO4,化学方程式为:2FeCl2 + 2H3PO4 + H2O2 

考查方向
解题思路
滤液D是FeCl2 溶液,加入双氧水和磷酸过滤可得沉淀FePO4,化学方程式为:2FeCl2 + 2H3PO4 + H2O2 

易错点
元素及其化合物的性质、离子方程式书写、化学计算
正确答案
20/9
解析
根据电子守恒,氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,
因此可得关系式:H2O2~H2C2O4,设双氧水质量为x,草酸质量为y,
34 90
x×17% y
34y=90×x×17%,所以x:y=20:9,
17%双氧水与H2C2O4的质量比为20:9,故答案为:20:9;
考查方向
解题思路
根据电子守恒找出双氧水与草酸的关系式,然后列式计算计算出17%双氧水与H2C2O4的质量比;
易错点
元素及其化合物的性质、离子方程式书写、化学计算
5.甲、乙、丙、丁分别由 H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成的化合物,可以发生如下图转化: 下列说法错误的是()
正确答案
解析
A.乙为 AlCl3
B.在酸性溶液在Fe2+、NO3—因发生氧化还原反应而不能大量共存。错误。
C.NaHCO3中粒子HCO3离子既能电离又能水解,根据物料守恒:甲溶液中粒子的等量关系:c(Na+)=c(HCO3-)(剩余)+c(CO32-)(电离)+c(H2CO3)(水解)
D.甲溶液中滴加少量丁溶液反应的离子方程式,小苏打可以将氢氧化钡全部的Ba2+和2OH反应完生成BaCO3沉淀,反应的离子方程式为2HCO3-+Ba2++2OH-=2BaCO3↓+2H2O,HCO3-+ Ba2++OH-= BaCO3↓+H2O是氢氧化钡过量的反应。
考查方向
解题思路
根据题意及格物质间的关系可知:甲为NaHCO3;乙为AlCl3;丙为HCl;丁为Ba(OH)2; 白色沉淀A是Al(OH)3; 无色气体B是CO2;白色沉淀C是BaCO3;无色溶液D是Na2CO3.发生的反应:甲+乙:AlCl3+3NaHCO3=3NaCl+Al(OH)3↓+CO2↑;甲+丙:HCl+NaHCO3=NaCl+H2O+CO2↑;甲+丁:Ba(OH)2+2NaHCO3=BaCO3↓+ Na2CO3+ 2H2O.
易错点
甲溶液中粒子的等量关系;甲溶液中滴加少量丁溶液反应的离子方程式。
知识点
【化学——选修3物质结构与性质】
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
21.①H、C、N、O四种元素的电负性由小到大的顺序为 。
②下列叙述不正确的是 。(填字母)
a.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水
b.HCHO和CO2分子中的中心原子均采用sp2杂化
c.C6H6分子中含有6个

d.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
22.Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子[Fe(CN)6]4 -中不存在 。
A、共价键
B、非极性键
C、配位键
D、σ键
E、π键
写出一种与 CN- 互为等电子体的单质分子式 。
23.根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于 区。
24.一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
① 确定该合金的化学式 。
② 若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离
(用含ρ的代数式表示,不必化简)为 cm。
正确答案
①H
②bc
③N≡C-O-H
解析
①同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,H的电负性最小,则电负性为H<C<N<O,故答案为:H<C<N<O;
②a、甲醛中含有羟基,与水可以形成氢键,故a正确;
b、二氧化碳为sp杂化,故B错误;
c、苯中碳碳键含有6个σ键,每个碳氢键含有一个σ键,苯分子中一共含有12个,故C错误;
d、常温下二氧化碳为气体,二氧化硅为固体,CO2晶体的熔点、沸点都比二氧化硅晶体的低,故d正确。
故答案为:bc
考查方向
解题思路
①根据元素周期表电负性的递变规律比较电负性强弱;
②分子中含有羟基,与水可以形成氢键,二氧化碳为sp杂化,苯中碳碳键含有6个σ键,另外还有6个碳氢σ键;
易错点
原子轨道的杂化、晶胞计算、元素电离能、电负性的含义及应用。
正确答案
①具有孤对电子
②B N2
解析
①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,故答案为:具有孤对电子
②六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键,所以CN-中共价键、配位键、σ键、π键;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质为N2,故答案为:B;N2
考查方向
题考查了电负性、原子轨道的杂化、等电子体、配合物结构、晶胞计算等,注意把握微粒空间构型的判断方法,需要学生具备知识的基础,题目难度中等。
解题思路
①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对;
②六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,三键中有1个σ键2个π键;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质。
易错点
原子轨道的杂化、晶胞计算、元素电离能、电负性的含义及应用。
正确答案
d区
解析
Ti原子核外电子排布为1s22s22p63s23p63d24s2,钛位于第四周期第ⅣB族,属于d区,故答案为:d
考查方向
本题考查了电负性、原子轨道的杂化、等电子体、配合物结构、晶胞计算等,注意把握微粒空间构型的判断方法,需要学生具备知识的基础,题目难度中等。
解题思路
根据Ti原子核外电子排布式解答。
易错点
原子轨道的杂化、晶胞计算、元素电离能、电负性的含义及应用。
正确答案
①Fe2Al
②
解析
①Fe位于顶点、面心、体心和棱心,数目为8×


②晶胞质量为:

,两个Fe原子之间的距离为边长的一半,则距离为:

考查方向
本题考查了电负性、原子轨道的杂化、等电子体、配合物结构、晶胞计算等,注意把握微粒空间构型的判断方法,需要学生具备知识的基础,题目难度中等。
解题思路
①根据均摊法计算化学式;
②计算出晶胞边长,即可进一步求出最近的两个Fe原子之间的距离。
易错点
原子轨道的杂化、晶胞计算、元素电离能、电负性的含义及应用。
4.用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤
④通入过量CO2生成Al(OH)3 沉淀
⑤加入盐酸生成Al(OH)3 沉淀 ⑥加入过量烧碱溶液
正确答案
解析
镁、铝都能与酸反应,但铝可溶于强碱所以可加入烧碱溶液溶解,过滤后可到NaAlO2溶液,在反应后的溶液中加入弱酸,可通入过量CO2,生成Al(OH)3沉淀,经过滤、洗涤可得到纯净的氢氧化铝.正确顺序为②③④③,故选B.
考查方向
解题思路
铝可与NaOH溶液反应生成NaAlO2,在反应后的溶液中加入弱酸,可通入过量CO2,生成Al(OH)3沉淀,经过滤、洗涤可得到纯净的氢氧化铝.
易错点
物质的分离、提纯的实验方案的设计
知识点
9、常温下,下列各组离子在指定溶液中一定能大量共存的是( )
①pH=0的溶液:Na+、C2O42﹣、MnO4﹣、SO42﹣
②pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣、S2﹣、SO32﹣
③水电离的H+浓度c(H+)=10﹣12mol·L﹣1的溶液中:Cl﹣、CO32﹣、NO3﹣、NH4+、SO32﹣
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl﹣、K+、SO42﹣
⑤使石蕊变红的溶液中:Fe2+、MnO4﹣、NO3﹣、Na+、SO42﹣
⑥中性溶液中:Fe3+、Al3+、NO3﹣、I﹣、Cl﹣、S2﹣.
正确答案
解析
:①pH=0的溶液中氢离子浓度为1mol/L,MnO4-在酸性条件下能够氧化C2O42-,在溶液中不能大量共存,故①错误;②pH=11的溶液中氢氧根离子浓度为0.001mol/L,CO32-、Na+、AlO2-、NO3-、S2-、SO32-离子之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;③水电离的H+浓度c(H+)=10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,CO32-、SO32-与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故③错误;④加入Mg能放出H2的溶液中存在大量氢离子,Mg2+、NH4+、Cl-、K+、SO42-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故④正确;⑤使石蕊变红的溶液中存在大量氢离子,MnO4-、NO3-在酸性条件下具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故⑤错误;⑥Fe3+能够氧化I-、S2-,Al3+在溶液中与S2-发生双水解反应,在溶液中不能大量共存,故⑥错误;根据以上分析,在溶液中能够大量共存的为②④
考查方向
解题思路
①pH=0的溶液为酸性溶液,高锰酸根离子在酸性条件下具有强氧化性,能够氧化醋酸根离子;②pH=11的溶液中存在大量氢氧根离子,:CO32-、Na+、AlO2-、NO3-、S2-、SO32-离子之间不满足离子反应发生条件,且都不与氢氧根离子反应;③水电离的H+浓度c(H+)=10-12mol•L-1的溶液为酸性或者碱性溶液,碳酸根离子、亚硫酸根离子能够与氢离子反应,铵根离子能够与氢氧根离子反应;④加入Mg能放出H2的溶液中存在大量氢离子,Mg2+、NH4+、Cl-、K+、SO42-离子之间不发生反应,都不与氢离子反应;⑤使石蕊变红的溶液为酸性溶液,溶液中存在大量氢离子,硝酸根离子、高锰酸根离子能够氧化亚铁离子;⑥铁离子能够氧化碘离子、硫离子,铝离子能够与硫离子发生双水解反应.
易错点
注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等
知识点
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁,请根据以下药品说明书回答问题:
17.药片上的糖衣可以起_______的作用,鉴定时溶解加盐酸的目的是____________。
18.某研究小组甲欲用KMnO4测定FeSO4的含量。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有__________、___________。
②滴定时,含硫酸亚铁的滤液放在___________(填仪器)中,高锰酸钾溶液放在__________(填仪器)中,滴定时加入___________(填“酚酞”或“甲基橙”或“石蕊”或“不用加”)指示剂,如何判断达到滴定终点_____________。
19.另一研究小组乙设计了如下测量方案:
①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。A过滤 B洗涤 C萃取 D分液 E冷却 F灼烧
正确答案
隔绝空气,防止被O2氧化 ; 防止Fe2+水解。
解析
因为Fe2+易被空气中的氧气氧化,故在Fe2+的药片上披上糖衣以隔绝空气、防止被O2氧化,鉴定时溶解加盐酸的目的是防止Fe2+水解。
考查方向
解题思路
依据亚铁盐等的性质、基本的实验操作解题。
易错点
(2)②中简答用语的规范性等。
正确答案
瓶中,溶液变为紫色,振荡,半分钟内不恢复原色,则滴定达到了终点。
解析
①精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有250 mL的容量瓶、胶头滴管。
②滴定时,含硫酸亚铁的滤液放在锥形瓶(因其易被氧化、不宜与空气长期或过度的接触)中,高锰酸钾溶液放在酸式滴定管中,滴定时加入 “不用加”指示剂(其本身的紫红色就是很好的指示剂);最后一滴酸性高锰酸钾溶液滴入锥形瓶中,溶液变为紫色,振荡,半分钟内不恢复原色,则滴定达到了终点。
考查方向
解题思路
依据亚铁盐等的性质、基本的实验操作解题。
易错点
(2)②中简答用语的规范性等。
正确答案
①2Fe2++2H++H2O2=2Fe3++2H2O。②A B F E。
解析
①检验过程中加过量H2O2(绿色氧化剂)反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作依次是:过滤、洗涤、灼烧、冷却,再称量。
考查方向
解题思路
依据亚铁盐等的性质、基本的实验操作解题。
易错点
(2)②中简答用语的规范性等。
3.下列所述事实与化学(离子)方程式相符的是 ( )
正确答案
解析
非金属性越强,最高价含氧酸的酸性越强,A选项中HClO3并不是最高价,故错误。
H2O2在此反应中为氧化剂, Fe3+为氧化产物,氧化剂的氧化性>氧化产物,故B正确。
氯气通入到硫代硫酸钠溶液中,应当得到硫酸根离子,故C错误。
充电时,电池的负极应当作为阴极发生还原反应,而不是氧化反应,D错误。
考查方向
解题思路
对选项进行逐一分析,每一个判断要做到有理有据。如判断非金属性要看最高价含氧酸的酸性,而A选项中Cl并非最高价,故不能作为非金属性强弱判断依据。
易错点
电池充放电时,两极反应的判断不明
知识点
扫码查看完整答案与解析








