- 原子轨道杂化方式及杂化类型判断
- 共55题
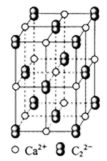
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2 
①上述化学方程式中的5种物质所属的晶体类型有 (填序号)。
a。离子晶体 b。分子晶体 c,原子晶体 d。金属晶体
②基态铜原子的核外电子排布式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
①晶体Q中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(4)已知苯酚(

正确答案
见解析。
解析
(1)
(2)①a、b、d ②1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)①a、d ②三角锥型 sp3
(4)< 
知识点
碳族元素包括C 、Si、Ge .Sn、Pb
(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过___________杂化与周围碳原子成键,多层碳纳米管的层与层之间靠___________结合在一起。
(2)CH4共用电子对偏向C,SiH4中偏向H,则C、Si、H的电负性由大到小的顺序为___________。
(3)用阶层电子对互斥理论推断SnBr2分子中Sn—Br键的键角__________120○ (填“>、<、=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞定点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为____________,每个Ba2+与________个O2-配位。
正确答案
(1)sp2 范德华力
(2)C>H >Si
(3) <
(4)PbBaO3,12。
解析
(1)石墨的每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键结合,形成无限的六边形平面网状结构,每个碳原子还有一个与碳环平面垂直的未参与杂化的2p轨道,并含有一个未成对电子,这些平面网状结构再以范德华力结合形成层状结构。因碳纳米管结构与石墨类似,可得答案。
(2)共用电子对偏向电负性大的原子,故电负性:C>H >Si。
(3) SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn原子含有故对电子,SnBr2空间构型为V型,键角小于120°。
(4)每个晶胞含有Pb4+:8×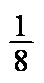
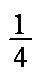
PbBaO3。Ba2+处于晶胞中心,只有1个,O2-处于晶胞棱边中心,共12个,
故每个Ba2+与12个O2-配位
知识点
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如下图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ2-
①YZ2-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
正确答案
见解析。
解析
(1)①4 ②ZnS
(2)sp3
(3)水分子与乙醇分子之间形成氢键
(4)① 正四面体 ②CCl4 或SiCl4 等
(5)16 mol 或16伊6. 02×1023个
知识点
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为________,1mol Y2X2含有σ键的数目为________。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是________。
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是________,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为________。
正确答案
(1)sp杂化;3mol或3×6.2×10 个
(2)NH3分子存在氢键
(3)N2O
(4)CuCl;CuCl+2HCl=H2CuCl3 (或CuCl+2HCl=H2[CuCl3])
解析
略。
知识点
本题包括ab两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按a题评分。
a乙炔是

(1)

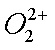
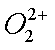

(2)将乙炔通入
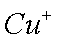
(3)乙炔与氢氰酸反应可得丙烯腈
(4)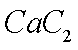


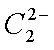
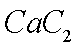

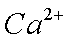

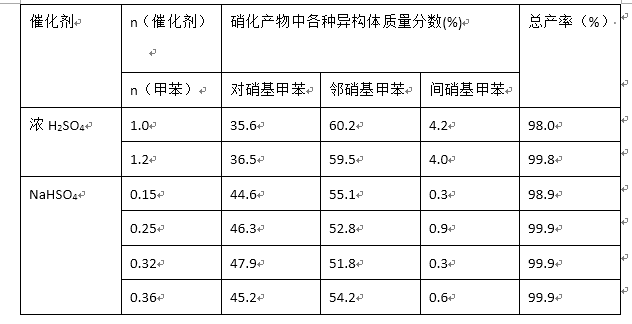
b对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
一种新的制备对硝基
(1)上述实验中过滤的目的是 。
(2)滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
① NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ 、 。
正确答案
a、(1)
(2)1s2 2s2 2p6 3s2 3p6 3d10
(3)sp2杂化、sp3 杂化 3
(4)4
b、(1)回收NaHSO4
(2)下 分液漏斗上口塞子未打开
(3)①0.32
②甲苯硝化主要得到对硝基甲苯和邻硝基甲苯
③在硝化产物中对硝基甲苯比例提高 催化剂用量少且能循环使用
解析
略
知识点
(一)下列描述中正确的是
A.CS2为V形的极性分子
B.Cl0— 3 的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO2— 3 的中心原子均为sp3杂化
(二)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)Ni0晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
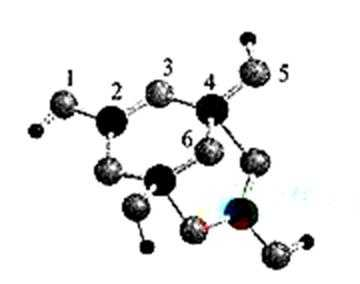
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
正确答案
(一)CD
(二)(1)1s22s22p63s23p63d 84s2
(2)>
(3)6、6
(4)LaNi5
(5)①一个
②氢键
③sp2、sp3
解析
(一)依据价层电子对互斥理论可知CS2为直线形的非极性分子,A错误;由价层电子对互斥理论可知Cl0— 3中中心原子的孤电子对数是1/2×(8-3×2)=1,所以Cl0— 3是三角锥形,B错误;硫原子最外层有6个电子,和氟原子之间有6对完全相同的成键电子对,C正确;SiF4和SO2— 3 的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,D正确。
(二)(1)镍属于28号元素,根据构造原理可以写出该原子的核外电子排布式,Ni的核外电子排布式是1s22s22p63s23p63d 84s2
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高。由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO。
(3)因为Ni0、Fe0的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni和O的配位数也均为6。
(4)晶胞中镧原子数=8×1/8=1;镍原子数=1+8×1/2=5,所以化学式为LaNi5
(5)①双键是由一个
知识点
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
(1)M固体的晶体类型是 。
(2)Y基态原子的核外电子排布式是 ;G分子中X原子的杂化轨道的类型是 。
(3)L的悬浊液加入Q的溶液,白色沉淀转化为黑色沉淀,其原因是 。
(4)R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
正确答案
见解析。
解析
(1)M的晶体类型,M为NH4Cl,属离子晶体;
(2)Y基态原子的电子排布:1s2 2s2 2p6 3s2 3p4,G分子中X原子的杂化轨道类型为sp3杂化;
(3)AgCl悬浊液中加入Ag2S,Ksp(AgCl)<Ksp(Ag2S),则溶液中的AgCl转化为Ag2S,由白色沉淀变为黑色沉淀;
(4)R的含氧酸跟RO42-为FeO42-,向其钠盐溶液中加入硫酸,溶液变黄,说明生成Fe3+,并有无色气体生成,反应中Fe的化合价降低,只能是O元素的化合价升高,则无色气体比为O2,反应的离子方程式为:4FeO42-+20H+==4Fe3++3O2↑+10H2O
①气体G可溶于水且水溶液呈碱性,知气体G为NH3,气体G由X的单质与H2化合得到,则X为N元素。
②Y的单质为黄色晶体,知Y为S元素。
③R的3d轨道电子数为为4s轨道的三倍,则R为第四周期元素,4s轨道电子数为2,3d轨道为6,R原子的电子排布为1s2 2s2 2p6 3s2 3p6 3d6 4s2,则R为Fe元素。
④Z的原子序数大于Y,且能与Na化合,则X为Cl元素。
⑤则Q为Na2S,J为NaCl,I为AgCl,M为NH4Cl
知识点
主要元素W、X、Y、Z的原子序数一次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为 ,W3分子的空间构型为 ;
(2)X单质与水发生主要反应的化学方程式为 ;
(3)化合物M的化学式为 ,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是 。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有 ,O—C—O的键角约为 ;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X︰Y︰Z= ;
(5)含有元素Z的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是 。
正确答案
(1)
(2)
(3)


(4)3:1:1
(5)激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量
解析
(1)W原子最外层电子数是次外层的3倍,说明W为O;在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高,可知化合物M为MgO,则Y为Mg;由此可得,W为第二周期的氧,Y为第三周期的镁,又因为主族元素W、X、Y、Z的原子序数依次增大,且X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍,可得X为第二周期的氟,则Z为第四周期的钾。W为O,所以W原子L层电子排布式为2s22p4;W3为O3,其空间构形是V形。
(2) X为F,故X单质与水反应的主要化学方程式是2F2+2H2O==4HF+O2。
(3) 化合物M的化学式是MgO, MgO熔点较高的原因是晶格能大。
碳酸二甲酯分子的结构简式为CH3O—CO—OCH3,其中羰基(—CO—)上的碳原子为平面构型,采用的是sp2杂化,而两个甲基(—CH3)中的碳原子为四面体构型,采用sp3杂化。由于中心碳原子无孤对电子,根据价层电子对互斥理论推测,O-C-O的键角约为120°。
(4) X占有棱的中心,则X个数为12×1/4=3;Y位于顶角,则Y个数为8×1/8=1;Z位于体心位置,则Z个数为1,故该晶体的组成为X:Y:Z=3:1:1。
(5)Z为K,因此含有元素Z的盐的焰色反应为紫色。许多金属盐都可以发生焰色反应,其原因是激发态的电子从能量高的轨道跃迁到能量低的轨道时,以一定的波长(可见光区域)光的形式释放能量。
知识点
(1)元素的第一电离能:AI Si(填“>”或:“<”)
(2)基态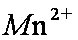
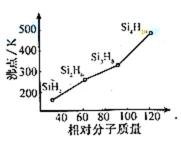
(3)硅烷(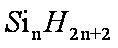
(4)硼砂是含结晶水的四硼碳酸,其阴离子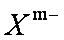
①在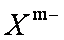
②鹏砂晶体由
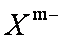
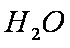
a离子键
b共价键
c金属键
d范德华力
e氢键
正确答案
见解析。
解析
(1)<
(2)1s22s22p63s23p23d5 或[Ar]3d5
(3)硅烷属于分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高
(4)①sp2 sp3 4.5 2
B周围有3个σ键时为sp2杂化;B周围有4个σ键时为sp3杂化(其中有一个键是配位键),一个B原子形成一个配位键后化合价降低一个单位;4号碳含有4个σ键(其中5号氧原子提供孤对电子,与4号碳形成配位键),该阴离子中共有2个B原子是sp3杂化,阴离子的化合价为-2价。
②ADE
硼砂晶体含金属离子(钠离子),属于离子晶体,含有离子键,水分子内部含有共价键,水分子的氧原子和硼砂晶体的氢原子可形成氢键
知识点
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为_______个。
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_______。

(3)H+可与H2O形成H3O+,H3O+原子采用_______杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为_______。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为a g·cm-3, NA表示阿伏伽德罗常数,则CaO晶胞体积为_______cm3
正确答案
(1) 2
(2)O—H键、氢键、范德华力;

(3)sp3;H2O中O原子有两对孤对电子,H3O+中O原子只有一对故对电子,排斥力较小
(4)
解析
(1)氧元素的基态核外电子排布式为:1s22s22p4,4个电子在三个轨道中排布,故未成对的电子个数是两个。
(2)化学键是强烈的相互作用;氢键的作用力比化学键弱,但比范德华力的作用力要强。

(3) H3O+的空间构型为三角锥型,故O原子的杂化方式为sp3;H3O+中O原子只有一对故对电子,排斥力较小,使得键角变大。
(4)根据NaCl的晶胞可知,一个晶胞含有4个CaO,设晶胞的体积为V,则:

知识点
扫码查看完整答案与解析