- 原子轨道杂化方式及杂化类型判断
- 共55题
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2 
①上述化学方程式中的5种物质所属的晶体类型有 (填序号)。
a。离子晶体 b。分子晶体 c,原子晶体 d。金属晶体
②基态铜原子的核外电子排布式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
①晶体Q中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(4)已知苯酚(

正确答案
见解析。
解析
(1)
(2)①a、b、d ②1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)①a、d ②三角锥型 sp3
(4)< 
知识点
碳族元素包括C 、Si、Ge .Sn、Pb
(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过___________杂化与周围碳原子成键,多层碳纳米管的层与层之间靠___________结合在一起。
(2)CH4共用电子对偏向C,SiH4中偏向H,则C、Si、H的电负性由大到小的顺序为___________。
(3)用阶层电子对互斥理论推断SnBr2分子中Sn—Br键的键角__________120○ (填“>、<、=”)
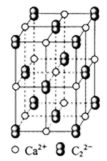
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞定点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为____________,每个Ba2+与________个O2-配位。
正确答案
(1)sp2 范德华力
(2)C>H >Si
(3) <
(4)PbBaO3,12。
解析
(1)石墨的每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键结合,形成无限的六边形平面网状结构,每个碳原子还有一个与碳环平面垂直的未参与杂化的2p轨道,并含有一个未成对电子,这些平面网状结构再以范德华力结合形成层状结构。因碳纳米管结构与石墨类似,可得答案。
(2)共用电子对偏向电负性大的原子,故电负性:C>H >Si。
(3) SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn原子含有故对电子,SnBr2空间构型为V型,键角小于120°。
(4)每个晶胞含有Pb4+:8×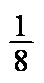
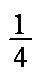
PbBaO3。Ba2+处于晶胞中心,只有1个,O2-处于晶胞棱边中心,共12个,
故每个Ba2+与12个O2-配位
知识点
本题包括ab两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按a题评分。
a乙炔是

(1)

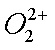
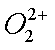

(2)将乙炔通入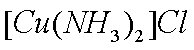
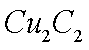
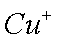
(3)乙炔与氢氰酸反应可得丙烯腈
(4)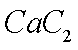


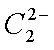
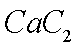

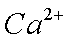

b对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
一种新的制备对硝基
(1)上述实验中过滤的目的是 。
(2)滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
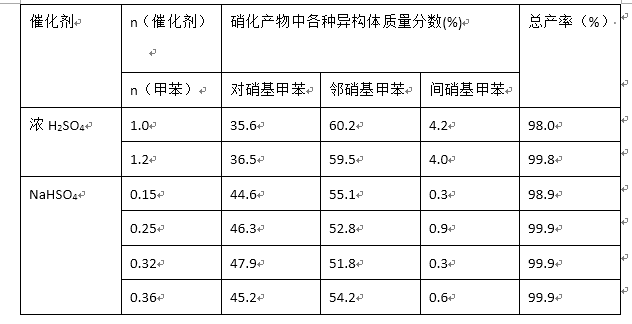
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
① NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ 、 。
正确答案
a、(1)
(2)1s2 2s2 2p6 3s2 3p6 3d10
(3)sp2杂化、sp3 杂化 3
(4)4
b、(1)回收NaHSO4
(2)下 分液漏斗上口塞子未打开
(3)①0.32
②甲苯硝化主要得到对硝基甲苯和邻硝基甲苯
③在硝化产物中对硝基甲苯比例提高 催化剂用量少且能循环使用
解析
略
知识点
主要元素W、X、Y、Z的原子序数一次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为 ,W3分子的空间构型为 ;
(2)X单质与水发生主要反应的化学方程式为 ;
(3)化合物M的化学式为 ,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是 。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有 ,O—C—O的键角约为 ;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X︰Y︰Z= ;
(5)含有元素Z的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是 。
正确答案
(1)
(2)
(3)


(4)3:1:1
(5)激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量
解析
(1)W原子最外层电子数是次外层的3倍,说明W为O;在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高,可知化合物M为MgO,则Y为Mg;由此可得,W为第二周期的氧,Y为第三周期的镁,又因为主族元素W、X、Y、Z的原子序数依次增大,且X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍,可得X为第二周期的氟,则Z为第四周期的钾。W为O,所以W原子L层电子排布式为2s22p4;W3为O3,其空间构形是V形。
(2) X为F,故X单质与水反应的主要化学方程式是2F2+2H2O==4HF+O2。
(3) 化合物M的化学式是MgO, MgO熔点较高的原因是晶格能大。
碳酸二甲酯分子的结构简式为CH3O—CO—OCH3,其中羰基(—CO—)上的碳原子为平面构型,采用的是sp2杂化,而两个甲基(—CH3)中的碳原子为四面体构型,采用sp3杂化。由于中心碳原子无孤对电子,根据价层电子对互斥理论推测,O-C-O的键角约为120°。
(4) X占有棱的中心,则X个数为12×1/4=3;Y位于顶角,则Y个数为8×1/8=1;Z位于体心位置,则Z个数为1,故该晶体的组成为X:Y:Z=3:1:1。
(5)Z为K,因此含有元素Z的盐的焰色反应为紫色。许多金属盐都可以发生焰色反应,其原因是激发态的电子从能量高的轨道跃迁到能量低的轨道时,以一定的波长(可见光区域)光的形式释放能量。
知识点
(1)元素的第一电离能:AI Si(填“>”或:“<”)
(2)基态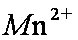
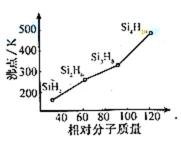
(3)硅烷(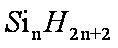
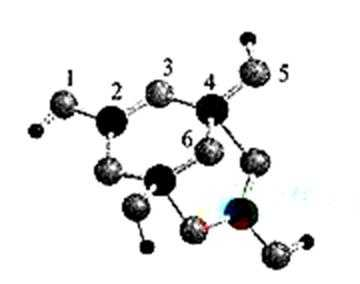
(4)硼砂是含结晶水的四硼碳酸,其阴离子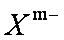
①在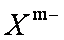
②鹏砂晶体由
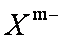
a离子键
b共价键
c金属键
d范德华力
e氢键
正确答案
见解析。
解析
(1)<
(2)1s22s22p63s23p23d5 或[Ar]3d5
(3)硅烷属于分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高
(4)①sp2 sp3 4.5 2
B周围有3个σ键时为sp2杂化;B周围有4个σ键时为sp3杂化(其中有一个键是配位键),一个B原子形成一个配位键后化合价降低一个单位;4号碳含有4个σ键(其中5号氧原子提供孤对电子,与4号碳形成配位键),该阴离子中共有2个B原子是sp3杂化,阴离子的化合价为-2价。
②ADE
硼砂晶体含金属离子(钠离子),属于离子晶体,含有离子键,水分子内部含有共价键,水分子的氧原子和硼砂晶体的氢原子可形成氢键
知识点
扫码查看完整答案与解析