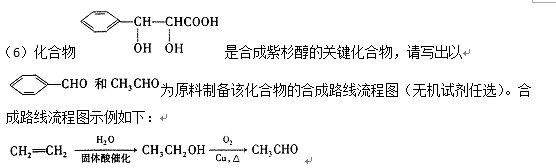
- 原子轨道杂化方式及杂化类型判断
- 共55题
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.“C1化学”是指以研究分子中只含一个碳原子的化合物为原料来合成一系列化工原料和燃料的化学。
(1)煤的气化是获得合成气的一种方法,写出煤气化的主要化学反应方程式:( );
(2)天然气的重整的化学反应方程式为 ( );
(3)最近科学家提出一种“绿色自由’’构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为甲醇。其技术流程如下:
①碳酸钾溶液所起的作用是( );
②写出上述流程中分解池中发生反应的化学方程 ( );
③写出合成塔中发生的化学反应方程式( );
④“绿色自由”构想技术流程中常包括物质和能量的循环利用,上述流程中能体现循环利用的物质有 ( ) 。
37.在电解炼铝过程中加入冰晶石(用“A”代替),起到降低Al2O3的熔点等诸多作用,冰晶石的生产原理如下:
根据题意完成下列填空:
(1)冰晶石的化学式为 ( ),含有离子键、( )化学键;
(2)生成物中含有10个电子的分子是( )(写分子式),该分子的空间构型为 ( ),中心原子的杂化方式为( );
(3)反应物中电负性最大的元素为( ),写出其原子最外层的电子排布图:( )
(4)冰晶石由两种微粒构成,冰晶石晶胞结构如图丁所示,位于大立方体顶点和面心,位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )(填具体的微粒符号)
(5)Al单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,请回答:
一个晶胞中Al原子的数目为( );Al晶体的密度为( )(用字母表示)
38.酒石酸(tartaric acid),即,2,3-二羟基丁二酸,是一种羧酸﹐存在于多种植物中﹐也是葡萄酒中主要的有机酸之一。作为食品中添加的抗氧化剂﹐可以使食物具有酸味。酒石酸最大的用途是饮料添加剂。也是药物工业原料,以烃A为原料合成酒石酸的流程如下:
已知:① 烃A中碳氢质量比为8:1
②
③ D的分子组成是C4H8O2Cl2,核磁共振氢谱显示其有三个峰。
(1)A的名称为: ( ),分子中最多有( )原子共面;
(2)B中所含官能团的名称是( ),B存在顺反异构,它的顺式结构为( );
(3)C转化为D的反应类型是( ),
F转化为G的化学反应方程式是 ( );
(4)F与乙二醇在一定条件下可以发生缩聚反应,该反应的化学方程式是___________
(5)C的同分异构体有多种,其中含有“—COO—”结构的有( )种;
(6)欲得到较纯净的酒石酸,需将G从其溶液中分离提纯,查阅相关资料得知G的溶解度受温度影响较大,则分离提纯G的方法是( )。
36.请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。“C1化学”是指以研究分子中只含一个碳原子的化合物为原料来合成一系列化工原料和燃料的化学。
(1)煤的气化是获得合成气的一种方法,写出煤气化的主要化学反应方程式:
;
(2)天然气的重整的化学反应方程式为 ;

①碳酸钾溶液所起的作用是 ;
②写出上述流程中分解池中发生反应的化学方程 ;
③写出合成塔中发生的化学反应方程式 ;
④“绿色自由”构想技术流程中常包括物质和能量的循环利用,上述流程中能体现循环利用的物质有 。
37.在电解炼铝过程中加入冰晶石(用“A”代替),起到降低Al2O3的熔点等诸多作用,冰晶石的生产原理如下:
2Al(OH)3+ 12HF+ 3 Na2CO3 = 2A+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)冰晶石的化学式为 ,含有离子键、 等化学键;
(2)生成物中含有10个电子的分子是 (写分子式),该分子的空间构型为 ,中心原子的杂化方式为 ;
(3)反应物中电负性最大的元素为 ,写出其原子最外层的电子排布图:



体心处▽所代表的微粒是 (填具体的微粒符号)

下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,请回答:
一个晶胞中Al原子的数目为 ;Al晶体的密度为 (用字母表示)
38.酒石酸(tartaric acid),即,2,3-二羟基丁二酸,是一种羧酸﹐存在于多种植物中﹐也是葡萄酒中主要的有机酸之一。作为食品中添加的抗氧化剂﹐可以使食物具有酸味。酒石酸最大的用途是饮料添加剂。也是药物工业原料,以烃A为原料合成酒石酸的流程如下:
已知:① 烃A中碳氢质量比为8:1
②
③ D的分子组成是C4H8O2Cl2 ,核磁共振氢谱显示其有三个峰。
(1)A的名称为: ,分子中最多有 个原子共面;
(2)B中所含官能团的名称是 ,B存在顺反异构,它的顺式结构为 ;
(3)C转化为D的反应类型是 ,
正确答案
正确答案
正确答案
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)写出反应Ⅰ的化学方程式 ( ) 。
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是( )。
(3)下列有关说法正确的是( ) 。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是( )。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式( ) 。37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为___ ___。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为 ___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为__ __。38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
(1)甲一定含有的官能团的名称是( ) 。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是( )。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写
(4)已知:R-C

R-ONa
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)( ) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是 ( ),反应II的反应类型是 ( ) 。
③反应IV的化学方程式是( ) 。
37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为______。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为____。
38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
(1)甲一定含有的官能团的名称是( )。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 ( )。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)( ) 。
(4)已知:
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)( ) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是( ),反应II的反应类型是( ) 。
③反应IV的化学方程式是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36. 硫酸铁铵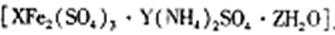
请回答下列问题:
(1)操作甲名称:( );操作乙名称:( )。
(2)硫酸亚铁溶液加硫酸酸化主要目的是 ( );滤渣A主要成分是();
(3)①试剂B最适宜的是()(填序号)
A.NaClO B.H2O2 C.酸化的KMnO4 D.K2Cr2O7
②除杂原理是( )(用离子方程式表示)
③若要检测Fe2+是否氧化完全,方法是( );能否用酸化的KMnO4溶液 ( ) (填“能”或“不能”),理由是 ( ) 。
(4)称取14.0g样品,配成100ml溶液,分成二等份,向一份加入足量NaOH溶液,过滤,洗涤,干燥得2.14g沉淀;另一份加入0.05mol Ba(NO3)2,恰好完全反应,则该产品化学式为 ( )。
37.A、B、C、D为原子序数依次增大的短周期元素。已知:
①A原子核外电子有5种运动状态;
②B是地壳中含量最多元素;
③A、C、D未成对电子数之比为1:3:1:
④E有生物金属之称,E4+与氩原子核外电子排布相同;
请回答下列问题:
(1)D原子价电子层结构为 ( ) ;基态E原子的核外电子排布式:( );
(2)5种元素所形成XY3型化合物化学式可能为( )、( );其中心原子杂化方式为 ( );
(3)与C周期相同的金属元素分别处于( )区;
(4)由B、D构成的以D为中心三原子分子的空间构型为 ( ) ;
(5)下列晶体的堆积方式与E单质晶体堆积方式相同的是( );
A.Po B.Zn C.Ag D.K
(6)B形成的两种同素异形体中在水中溶解度更大的是( )(填化学式);原因是( )。
38.我国科研人员从天然姜属植物分离出一种具有显著杀菌、消炎、解毒作用的化合物H,H的合成路线如下:
(1)A→B的反应类型是 ( )。
(2)化合物B中的含氧官能团为 ( ) 和( )(填官能团名称)。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式:( ) 。
I.苯环上有两个取代基 II,分子中有6种不同化学环境的氢
Ⅲ.既能与FeCl3溶液发生显色反应,又能发生银镜反应,水解产物之一也能发生银镜反应
(4)实现F→G的转化中,加入的化合物X( C12H14O3)的结构简式为 ( ) 。
(5)写出F与新制氢氧化铜悬浊液反应的化学方程式: ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请从36~38题中任选一题作答
36.【化学_选修2:化学与技术】工业生产纯械的工艺流程示意图如下
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式( )。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是( )(填化学式),原因是( )。
(3)通入C和D气体后发生反应的化学方程式是 ( ) 。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品 ( )(填写化学式),通氨气与加入细小食盐颗粒的作用是( ) 。
(5)写出⑤锻烧发生反应的化学方程式( )产品纯碱中含有碳酸氢钠。若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数ω(NaHCO3)= ( )。[加热前后的质量分别用m(加热前)和m(加热后)表示]
37.【化学——选修物质结构与性质】元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为( ),该元素的名称是( );
(2)在X与Z形成的化合物XZ3中,X的杂化类型是( ),该化合物的空间构型为( );短周期元素形成的化合物中与XZ3互为等电子体的是( );
(3)请写出X的两种含氧酸的化学式 ( ) 、( ),其中酸性较强的是( )。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 ( )。
38.【化学一选修有机化学基础】化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过下图所示方法合成:
(1)反应①属于( )(填反应类型)。
(2)化合物Ⅰ的分子式为( ),Ⅴ中含有的含氧官能团的名称为
(3)合成化合物Ⅱ的方法为:
合成肉桂酸的反应式中,反应物的物质的量之比为1︰1,生成物A呈酸性,写出A的一种同分异构体的结构简式 ( ) 。
(4)化合物Ⅰ和Ⅱ反应还可以得到一种酯,写出该反应的化学方程式 ( )。
(5)下列关于化合物Ⅴ的说法正确的是( )(双选,填字母)。
A.分子中有三个苯环
B.能发生水解反应
C.使酸性KMnO4溶液褪色
D.与FeCl3发生显色反应
(6)写出肉桂酸的两种同分异构体,满足①分子中含有苯环,②羧基与苯环直接相连。(书写的异构体中含有相同的官能团,写成邻、
正确答案
36.
37.
38.
解析
解析已在路上飞奔,马上就到!
知识点
选考题:请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.2012年4月15日,央视曝光河北一药用胶囊厂用皮革废料所生产明胶作原料。这些企业用生石灰处理皮革废料进行脱色漂白和清洗,随后熬制成工业明胶,卖给浙江新昌县药用胶囊生产企业,最终流向药品企业,进入消费者腹中。记者调查发现9家药厂的13个批次药品所用胶囊重金属铬含量超标。重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成( ) 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2= 2Fe2O3+8Na2CrO4+8CO2 为了加快该反应的反应速率,可采取的措施是( ) 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+= Cr2O72-+H2O;
3CrO42-+4H+= Cr3O102-+2H2O① 往混合溶液甲中加入硫酸必须适量的原因是 ( ) 。
② 混合溶液乙中溶质的化学式是( ) 。
(4)在含Cr2O72-废水中存在着平衡:
,请写出该平衡的平衡常数表达式K=( ),若继续加水稀释,平衡将( )移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O - □Cr(OH)3+□S2O32-+□OH-
37.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
(1)A的基态原子中能量最高的电子,其电子云在空间有 ( )个方向,原子轨道呈( )形。
(2)E2+的基态核外电子排布式为 ( ) 。
(3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是( ) 。由B、C二种元素组成的分子与AC2互为等电子体的分子的结构式为 ( )。(用化学式表示)
(4)BD3 中心原子的杂化方式为 ( ),其分子空间构型为( ) 。
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为9.00g/cm3,晶胞中该原子的配位数为( );F的原子半径是( )cm;(阿伏加德罗常数为NA,要求列式计算)。
38.(15分)Grignard试剂(卤代烃基镁)广泛运用于有机合成中,Grignard试剂的合成方法是:

现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性。合成线路如下:
请按要求填空:
(1)用系统命名法对物质B进行命名:( );
(2)在I-J过程中所加入的二元酸的结构简式为:( );
(3)反应①~⑧中属于取代反应的有( )个;属于消去反应的有 ( )个.
A.1个 B.2个 C.3个 D.4个
(4)写出下列过程的反应方程式(有机物请用结构简式表示):
B―→D ( );
I―→J ( ) ;
(5)写出一种满足以下条件的D的同分异构体的结构简式 ( ) 。
①能与Na反应反出H2;②核磁共振氢谱有四组峰;③有二种官能团。(注:羟基不能与碳碳双键中的碳原子直接相连)
36.2012年4月15日,央视曝光河北一药用胶囊厂用皮革废料所生产明胶作原料。这些企业用生石灰处理皮革废料进行脱色漂白和清洗,随后熬制成工业明胶,卖给浙江新昌县药用胶囊生产企业,最终流向药品企业,进入消费者腹中。记者调查发现9家药厂的13个批次药品所用胶囊重金属铬含量超标。重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+= Cr2O72-+H2O ;
3CrO42-+4H+= Cr3O102-+2H2O① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O - □Cr(OH)3+□S2O32-+□OH-37.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
(1)A的基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
(2)E2+的基态核外电子排布式为 。
(3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是 。由B、C二种元素组成的分子与AC2互为等电子体的分子的结构式为 。(用化学式表示)
(4)BD3 中心原子的杂化方式为 ,其分子空间构型为 。

38.(15分)Grignard试剂(卤代烃基镁)广泛运用于有机合成中,Grignard试剂的合成方法是:RX+Mg
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性。合成线路如下:
请按要求填
(1)用系统命名法对物质B进行命名: ;
(2)在I-J过程中所加入的二元酸的结构简式为: ;
(3)反应①~⑧中属于取代反应的有 个;属于消去反应的有 个.
A.1个 B.2个 C.3个 D.4个
(4)写出下列过程的反应方程式(有机物请用结构简式表示):
B―→D ;
I―→J ;
(5)写出一种满足以下条件的D的同分异构体的结构简式 。
①能与Na反应反出H2;②核磁共振氢谱有四组峰;③有二种官能团。(注:羟基不能与碳碳双键中的碳原子直接相连)
正确答案
正确答案
扫码查看完整答案与解析