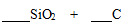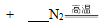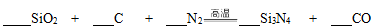- 化学用语
- 共784题
7.下列有关物质的性质或该物质性质的应用均正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
1.下列说法或表达正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图。该拒食素与下列某试剂充分反应,所得有机物分子中官能团个数增加,则该试剂是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.按要求完成下列填空
Ⅰ.已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l) ΔH=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的ΔH=( )
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化
b.υ正(
c.混合气体的平均相对分子质量不发生变化
d.
②在某温度下,反应物的起始浓度分别为:c(CO)= 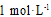
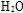

(3)熔融碳酸盐燃料电池的电解质为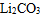
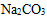
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得: 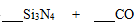
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30mol氮气,反应生成了5mol一氧化碳,则此时混合气体的平均摩尔质量是( )。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(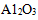
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
正确答案
Ⅰ.
(1)-2219.9 kJ/mol
(2)b d 0.5
(3)CO-2e_+CO32-=2CO2
Ⅱ.
(1)3 6 2 1 6
(2)28 g/mol
(3) AC
解析
解析已在路上飞奔,马上就到!
知识点
3.右下表为元素周期表的一部分,其中A、X、Y、W、Z为短周期元素,W元素的核电荷数为X元素的2倍。据此,下列说法中错误的是
正确答案
解析
A、X、Y、W、Z为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,W与X处于同一主族,且W元素原子的核电荷数为X元素的2倍,那么X为O,W为S,可知Y为Si、Z为P、T为As,A为Cl,B为Br,
A.非金属性X>W>Z,对应气态氢化物的热稳定性变化减弱;电子层越多原子半径越大,则原子半径为Z>W>X,故A正确;
B.电解A的钠盐溶液,生成NaOH、氢气、氯气,阴极生成NaOH,为使钠离子向阴极移动,选阳离子交换膜,故B错误;
C.S可以单质存在,非金属性Y、Z、W、A逐渐增强,对应最高价氧化物的水化物的酸性依次递增,故C正确;
D.As位于金属与非金属性的交界处,则T元素的单质具有半导体特性,As的化合价为+3价时为中间价态,则T2X3具有氧化性和还原性,故D正确
考查方向
位置结构性质的相互关系应用;元素周期律和元素周期表的综合应用
解题思路
A、X、Y、W、Z为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,W与X处于同一主族,且W元素原子的核电荷数为X元素的2倍,那么X为O,W为S,可知Y为Si、Z为P、T为As,A为Cl,B为Br,结合元素周期律与元素化合物结构与性质解答
易错点
D项:As2O3中据价态推断氧化性和还原性
教师点评
本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意W、X为元素推断的突破口,题目难度不大
知识点
6.A、B、C、D、E五种元素分属于三个短周期,且原子序数依次增大。A、C同主族,可形成离子化合物CA;B、D同主族,且D的原子序数是B的2倍,则下列说法正确的是
正确答案
解析
A、B、C、D、E五种元素分属于三个短周期,且原子序数依次增大.A、C同主族,可形成离子化合物CA,则A为H,C为Na;B、D同主族,且D的原子序数是B的2倍,则B为O,D为S,结合原子序数为E为Cl,
A.B元素在周期表中的位置为第二周期ⅥA族,故A错误;
B.D的氧化物为二氧化硫,与有色物质化合生成无色物质,E的单质为氯气,与水反应生成HClO具有强氧化性,漂白的原理不相同,故B错误;
C.由A、B、C、D组成的两种盐分别为硫酸氢钠、亚硫酸氢钠,反应可产生SO2气体,故C正确;
D.上述元素的非金属气态氢化物还原性最强的是D,还原性S2->Cl-,故D错误
考查方向
位置、结构与性质的应用
解题思路
A、B、C、D、E五种元素分属于三个短周期,且原子序数依次增大.A、C同主族,可形成离子化合物CA,则A为H,C为Na;B、D同主族,且D的原子序数是B的2倍,则B为O,D为S,结合原子序数为E为Cl,然后结合元素周期律及元素化合物来解答
易错点
D项:非金属气态氢化物还原性
教师点评
本题考查位置、结构与性质的应用,把握元素的位置、元素化合物知识推断元素为解答的关键,侧重分析与推断能力的考查,注意元素周期律及元素化合物知识的应用,题目难度不大
知识点
3.相同主族的短周期元素中,形成的单质一定属于相同类型晶体的是
正确答案
解析
A、第IA族的氢气是分子晶体,其它碱金属是金属晶体,形成的单质晶体类型不相同,故A错误;
B、第IIIA族硼是分子晶体,其它是金属晶体,形成的单质晶体类型不相同,故B错误;
C、C、Si都属于第IVA族元素,属于原子晶体,其它是金属晶体,形成的单质晶体类型不相同,故C错误;
D、第VIA族形成的都是分子晶体,形成的单质晶体类型相同,故D正确
考查方向
元素周期表的结构及其应用
解题思路
A、第IA族的氢气是分子晶体,其它碱金属是金属晶体;
B、第IIIA族硼是分子晶体,其它是金属晶体;
C、C、Si都属于第IVA族元素,属于原子晶体,其它是金属晶体;
D、第VIA族形成的都是分子晶体
易错点
B项中硼是分子晶体
教师点评
本题考查单质、原子晶体,侧重考查基本概念,明确单质的含义、晶体类型的划分、元素在周期表中的位置即可解答,题目难度不大
知识点
6.四种短周期元素X、Y、Z、W的原子序数依次增大,X、W原子序数之和等于Y、Z原子序数之和。X、W两元素位于同一主族,Y元素是其所在周期中原子半径最大的元 素(惰性气体元素除外),Z的单质是银白色固体,易导电,常温下不易溶于浓硫酸。下列有关推断错误的是
正确答案
解析
四种短周期元素X、Y、Z、W的原子序数依次增大,Z单质是银白色固体,易导电,常温下不易溶于浓硫酸,短周期元素中能够与浓硫酸发生钝化的为金属Al,则Z为Al元素;Y元素是其所在周期中原子半径最大的元素(惰性气体元素除外),则Y位于ⅠA族,为Li或Na元素;W的原子数大于Al,又X、W两元素位于同一主族,则X、W族序数大于Ⅲ,故Y只能为Na元素;X、W原子序数之和等于Y、Z原子序数之和,则X、W的原子序数之和=11+13=24,设X、W的原子序数分别为x、x+8,则x+x+8=24,解得x=8,则X为O、W为S元素,
A.X为O元素,其氢化物为水,分子中存在氢键,导致水的沸点较高,故A正确;
B.非金属性O>S,非金属性越强,对应离子的还原性越弱,则阴离子还原性:X<W;金属性Na>Al,金属性越强,对应离子的氧化性越弱,则阳离子氧化性:Z>Y,故B错误;
C.X为O、Y为Na,二者形成的过氧化钠为离子化合物,过氧化钠中含有共价键,故C正确;
D.Z为Al、W为S,硫化铝在水溶液中发生双水解反应,所以硫化铝在水溶液中不能稳定存在,故D正确
考查方向
原子结构与元素周期律
解题思路
四种短周期元素X、Y、Z、W的原子序数依次增大,Z单质是银白色固体,易导电,常温下不易溶于浓硫酸,短周期元素中能够与浓硫酸发生钝化的为金属Al,则Z为Al元素;Y元素是其所在周期中原子半径最大的元素(惰性气体元素除外),则Y位于ⅠA族,为Li或Na元素;W的原子数大于Al,又X、W两元素位于同一主族,则X、W族序数大于Ⅲ,故Y只能为Na元素;X、W原子序数之和等于Y、Z原子序数之和,则X、W的原子序数之和=11+13=24,设X、W的原子序数分别为x、x+8,则x+x+8=24,解得x=8,则X为O、W为S元素,据此结合元素周期律知识进行解答
易错点
A项:氢键的存在导致沸点较高
教师点评
本题考查了原子结构与元素周期律的应用,题目难度中等,根据题干信息正确推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系
知识点
下列叙述中正确的是:
正确答案
解析
略
知识点
7.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析