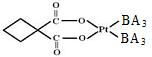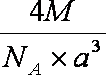- 化学用语
- 共784题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、
水处理等, 亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应1”反应速率的措施有_________________、__________________等。
(2)“反应1”的离子方程式是
(3)“反应2”的的氧化剂是_________,该反应的化学方程式为________________。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是___________________________。
(5)从“母液”中可回收的主要物质是______________。
(6)“冷却结晶”后经______________(填操作名称)即可获得粗产品。
正确答案
(1)适当升高反应温度,增大吸收液浓度,增大SO2与吸收液的接触面积(各2分)
(2)2ClO3- + SO2 == 2ClO2 + SO42-(2分)
(3)ClO2 (2分) H2O2 + 2ClO2 + 2NaOH = 2NaClO2 + 2H2O + O2 (2分)
(4)常压蒸发温度过高,亚氯酸钠容易分解 (2分)
(5)Na2SO4 (2分)
(6)过滤 (2分)
解析
略
知识点
(18分)K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:
正确答案
A
解析
略。
知识点
下列解释事实的方程式不准确的是
正确答案
解析
略
知识点
下列解释事实的方程式表达不正确的是
正确答案
解析
略
知识点
将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。则下列说法不正确的是
正确答案
解析
略
知识点
普通钢中加入少量的钒(化学式V),就熊极大改善钢的弹性和强度,使钢的抗磨损和抗爆裂性大增,且既耐高温又抗奇寒,因此含有“合金维生素”之称。工业上回牧废钒催化剂(含有
回答下列问题:
(1)
(2)滤渣l中的主要成分是____。(填写化学式)
(3)步骤②中发生反应的离子方程式为____。
(4)步骤③的变化过程可简化为(HA表示有机萃取剂):

(5)调节
在实际生产中,步骤⑥中加入氨水调节溶液的最佳pH为
(6)该工艺流程中,可以循环利用的物质有一
(7)写出步骤⑧中用铝热法冶炼金属钒的化学方程式____。
正确答案
答案:(1)+4,+5(2分)
(2)V2O5 、SiO2(2分)
(3)V2O5+ SO32-+4H+ = 2VO2+ + SO42-+2H2O(2分)
(4)加入硫酸使平衡向左移动,使VOSO4进入水层(2分)
(5)1.7—1.8(2分)
(6)氨气 有机萃取剂(2分)
(7)3V2O5+10Al
解析
略
知识点
锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正级材料。回答下列问题:
(1)将锂在纯氮气中燃烧可制得Li3N,其反应的化学方程为 。
(2)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2
(3)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得
Li2FeSiO4,写出反应的化学方程式 ,
制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是 。
(4)将一定浓度磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出LiFePO4沉淀,阳极的电极反应式为 。
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li

。
正确答案
(1)
(2)
(3)
(4)
(5)
解析
略
知识点
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1。由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1。回答下列问题。
(1)该配位化合物X的化学式为 。
(2)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如图,其中碳原子的杂化方式有 。
(3)D元素原子的最外层电子轨道表式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5) 元素B的单质可以和电石(CaC2)反应,生成氰氨化钙(CaCN2), 氰氨化钙和水反应可生成NH3。与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式 。
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式 。单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为ρ= g/cm3。
正确答案
(1)Cu(NH3)4SO4`H2O (1分)
(2)sp3杂化和sp2杂化
(3)
(4)H2O与H2O2之间形成氢键
(5)CO2或N2O ; CaCN2+3H2O=CaCO3+2NH3↑
(6)6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
解析
略
知识点
27.某回收废料中含Al2O3、Fe2O3、Co2O3·CoO多种金属氧化物,某实验室科技人员欲将之分离并制备有关物质,设计流程如下图所示:
(1)过程②的离子方程式为 。
(2)过程④会产生有毒气体,反应的化学方程式为 。
(3)过程⑥用于制备绿色水处理剂,反应的离子方程式为 。
(4)过程⑦中碳酸钠溶液起的作用是 。
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下表是粉红色的CoCl2·6H2O晶体受热分解时的情况:
认真分析以上数据,填写下列空白。③物质的化学式是____________。写出CoCl2·6H2O晶体受热分解生成②的化学反应方程式 。
正确答案
(1)AlO2-+2H2O +CO2 =Al(OH)3↓+HCO3-
(2)Co2O3·CoO+8HCl=3CoCl2+Cl2↑+ 4H2O
(3)2Fe(OH)3 +3ClO-+ 4OH-=2FeO42-+3Cl-+5H2O
(4)调整pH,提供碳酸根离子,使Co2+沉淀为CoCO3
(5)CoCl2·H2O CoCl2·6H2O
解析
略
知识点
解释下列事实的方程式正确的是
正确答案
解析
略。
知识点
扫码查看完整答案与解析