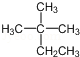
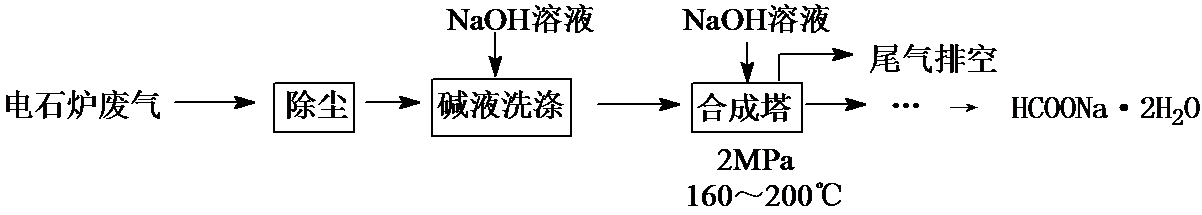- 有机物结构式的确定
- 共21题
11.【化学-—选修2:化学与技术】
甲酸钠广泛用作催化剂和稳定合成剂,印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。用电石炉废气(CO 75~90%,以及少量CO2、H2S、N2、CH4等)其合成部分工艺流程如下:
(1)上述工艺用碱液洗涤的目的是 ,可能发生的反应有 (列举两例)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是 ;最后排空的尾气主要成分是 。
(3) 合成时,得到的HCOONa溶液溶质质量分数约为5%,合成塔反应液中分离出HCOONa·2H2O的主要步骤有 、 、 ,再经先涤干燥得到。
(4) 甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为 。
(5) 在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要工业产品保险粉(Na2S2O4)同时产生二氧化碳,该反应的离子方程式为 。
正确答案
(1)除去其中的CO2、H2S等酸性气体
CO2+2NaOH =Na2CO3+H2O, H2S+2NaOH = Na2S + H2O等
(2)使尾气中的CO被充分吸收;N2和CH4
(3)蒸发浓缩、冷却结晶、过滤
(4)2HCOONa 
(5)HCOO- + 2SO2 + OH-= S2O4 2-+ CO2 +H2O
解析
电石炉废气(CO 75~90%,以及少量CO2、H2S、N2、CH4等)先除尘,然后用碱液洗涤,溶液中CO2、H2S反应生成盐,然后将气体通入合成塔,并加入NaOH溶液、加热至160﹣200℃、加压,最终得到HCOONa.2H2O,最后剩余N2和CH4,将尾气排空。
(1)碱液具有碱性,能吸收酸性气体,CO2、H2S都是酸性气体,被碱液吸收,发生的反应为CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O,
故答案为:除去其中的CO2、H2S等酸性气体;CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O;
(2)反应物接触面积越大,反应越充分,合成工艺中采用循环喷射吸收合成目的是增大反应物接触面积,使尾气中的CO被充分吸收;反应过程中N2、CH4不参加反应,所以最后排空的尾气主要成分是N2和CH4,
故答案为:使尾气中的CO被充分吸收;N2、CH4;
(3)从溶液中获取溶质采用蒸发浓缩、冷却结晶、过滤再经洗涤干燥得到,故答案为:蒸发浓缩;
(4)甲酸钠高温时分解生成草酸钠和氢气,反应方程式为2HCOONa
故答案为:2HCOONa
(5)反应物是甲酸钠、NaOH和二氧化硫,生成物是Na2S2O4和二氧化碳、水,离子反应方程式为HCOO﹣+2SO2+OH﹣=S2O42﹣+CO2+H2O,
故答案为:HCOO﹣+2SO2+OH﹣=S2O42﹣+CO2+H2O
考查方向
解题思路
电石炉废气(CO 75~90%,以及少量CO2、H2S、N2、CH4等)先除尘,然后用碱液洗涤,溶液中CO2、H2S反应生成盐,然后将气体通入合成塔,并加入NaOH溶液、加热至160﹣200℃、加压,最终得到HCOONa.2H2O,最后剩余N2和CH4,将尾气排空,
(1)碱液具有碱性,能吸收酸性气体;
(2)反应物接触面积越大,反应越充分;最后排空的尾气主要成分是N2和CH4;
(3)从溶液中获取溶质采用蒸发浓缩、冷却结晶、过滤再经洗涤干燥得到;
(4)甲酸钠高温时分解生成草酸钠和氢气;
(5)反应物是甲酸钠、NaOH和二氧化硫,生成物是Na2S2O4和二氧化碳、水,根据反应物、生成物书写离子方程式.
易错点
本题考查物质分离和提纯,为高频考点,易错点在离子反应、基本实验操作、氧化还原反应等知识点,明确反应原理及操作基本方法是解本题关键。
知识点
8.CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如下:
下列分析正确的是
正确答案
解析
A.CPAE中含有1个酯基与2个酚羟基,可与NaOH反应,含有2个酚羟基与1个碳碳双键,可与溴水发生反应,含有苯环与碳碳双键,可与氢气发生加成反应,则1molCPAE与NaOH溶液,浓溴水和氢气反应时最多消耗的NaOH、Br2和H2的物质的量分别是3mol、4mol和7mol,正确;
B.咖啡酸分子中,苯环上6个碳原子与6个H原子共面,碳碳双键中的碳取代苯环上的氢原子,则分子中至少有7个碳原子共平面,错误;
C.咖啡酸中含有酚羟基,可与溴水发生取代,与氢气发生加成反应,但不能发生消去反应,错误;
D.CAPE与咖啡酸均含有酚羟基,遇FeCl3溶液均可显紫色,所以不能检测上述反应中是否有CPAE生成,错误;所以答案为A。
考查方向
解题思路
本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重羧酸、酚、醇等物质性质的考查,选项B为解答的难点,注意酚-OH不能发生消去反应。
咖啡酸不能发生消去反应,CPAE不能发生消去反应,均含苯环可发生加成反应,-OH可发生取代反应;
咖啡酸、CPAE均含酚-OH,均与FeCl3溶液发生显色反应,则不能检验是否有CPAE生成;
含有酚羟基,在邻位和对位发生取代反应,含有碳碳双键,可发生加成反应,则1 mol的咖啡酸最多可与4 mol Br2发生反应;
苯环上所有碳原子处于同一平面上,乙烯中两个碳原子处于同一平面上,咖啡酸中含有苯环碳碳双键,所以所有碳原子可能处于同一平面上。
易错点
1、咖啡酸分子中碳原子共平面的结构分析。
2、含有酚羟基,在邻位和对位发生取代反应,含有碳碳双键,可发生加成反应。
知识点
8.青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )
正确答案
解析



考查方向
解题思路



易错点
等效或对称碳原子的数量的判定。
知识点
10.下列说法正确的是 ( )
正确答案
解析
根据有机物的结构简式
B.在碱性条件下,CH3CO18OC2H5的水解产物是乙酸盐,所以B错误;
C.在一定条件下,乙酸、氨基乙酸、蛋白质均含有酸性官能团,能与NaOH发生反应,所以C正确;
D.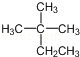
考查方向
解题思路
A.根据有机物的结构简式确定有机化合物的分子式
B.在碱性条件下,CH3CO18OC2H5的水解产物是乙酸盐
C.在一定条件下,乙酸、氨基乙酸、蛋白质均含有酸性官能团,能与NaOH发生反应
D.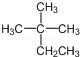
易错点
A.不能准确确定有机化合物的分子式;
B.不了解酯类水解的实质
C.不了解乙酸、氨基乙酸、蛋白质与NaOH发生反应的原理
D.不能熟练掌握和应用有机物的系统命名法
知识点
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯的反应:
其中乙苯在CO2气氛中的反应可分两步进行:
17.上述乙苯与CO2反应的反应热△H=________________________。
18.下列叙述不能说明乙苯与CO2反应已达到平衡状态的是_____________________。
a.恒温恒压时气体密度不变 b.C(CO2) = C(CO)
c.消耗1molCO2同时生成 1molH2O d.CO2的体积分数保持不变
19.在3L密闭容器内,乙苯与CO2发生反应。在三种不同的条件下进行实验,乙苯、CO2的起始浓度均分别为1 mol/L和3 mol/L,其中实验I在T1。C、P1 Pa下,而实验II、III分别改变了某一个实验条件(假设均不影响物质的状态),乙苯的浓度随时间的变化如图1所示。
①实验I乙苯在0-50min时的反应速率为_______________。
②实验Ⅱ可能改变条件的是__________________________。
③图2是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
20.实验I达到平衡后,在该温度下,向该容器中再通入乙苯和CO2各1mol,重新达到平衡时,乙苯的转化率将 (填“增大”、“减小”或“不变”),此时平衡常数为______________。
正确答案
(1)—210KJ/mol
解析
(1)观察三个热化学方程式,发现已知焓变的A+B可以得到乙苯与二氧化碳的反应,根据盖斯定律,则乙苯与二氧化碳反应的焓变=△H1+△H2=[(-125)+(-85)]kJ/mol=-210kJ/mol;
考查方向
解题思路
(1)根据盖斯定律结合热化学方程式分析;
易错点
不能灵活应用盖斯定律致错;没有理解化学平衡的特点致错;不能根据平衡时浓度进行平衡常
数的计算。
正确答案
(2) b c
解析
②恒温恒压时气体体积发生变化,而质量不变,所以密度不变,说明已达平衡,故a错误;虽然各组分的变化浓度之比等于化学方程式中系数之比,但是各组分的平衡浓度之比不一定等于化学方程式中系数之比,因此二氧化碳和一氧化碳浓度相等时反应不一定达到平衡,故b正确;二氧化碳和水的系数之比等于1∶1,消耗1molCO2同时生成1molH2O,说明不同物质的正反应速率等于化学方程式中系数之比,缺少逆反应速率,因此不能说明达到平衡,故c正确;二氧化碳是反应物,其体积分数逐渐减小,若保持不变,说明反应已达平衡,故d错误;
考查方向
解题思路
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
易错点
不能灵活应用盖斯定律致错;没有理解化学平衡的特点致错;不能根据平衡时浓度进行平衡常
数的计算。
正确答案
(3)①0.012mol/(L•min) ②加入催化剂 ③ (只要拐点位置正确即可,未标出12.5不扣分)
解析
①观察图I,0~50min内△c(乙苯)=(1.0—0.4)mol/L=0.6mol/L,由于v=△c/△t,则v(乙苯)= 0.6mol/L÷50min=0.012mol/(L•min);
②对比图I、图II,发现I→II时,单位时间内乙苯的变化浓度增大,说明反应速率加快,但是平衡时乙苯的浓度相等,说明平衡没有移动;由于乙苯与二氧化碳的反应是气体体积增大的放热反应,根据浓度、压强、温度和催化剂对化学平衡的影响规律推断,实验II可能改变的条件是加入催化剂;
③同理,推断实验I→III时,反应速率增大,平衡向逆反应方向移动,说明改变的条件是升高温度,因此画出的曲线满足以下几个要点:起点与实验I相同,未达平衡前,实验III的反应速率比I大,平衡后苯乙烯的体积分数比实验I的小;
考查方向
解题思路
(3)①根据图I中乙苯的浓度变化,求出反应速率;
②根据图I中实验Ⅱ改变条件平衡不移动,反应速率增大;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小;
易错点
不能灵活应用盖斯定律致错;没有理解化学平衡的特点致错;不能根据平衡时浓度进行平衡常
数的计算。
正确答案
(4)减小 0.375
解析
(4)增大乙苯的浓度,虽然平衡右移,乙苯的变化浓度增大,但是乙苯的起始浓度也增大,且变化浓度增大的程度小于起始浓度增大的程度,因此乙苯的转化率减小;平衡常数只与温度有关,与浓度改变无关,因此实验I中各组分的平衡浓度计算出的平衡常数就是此时的平衡常数,依题意可知实验I反应中各组分的起始、变化、平衡浓度,则:
C6H5CH2CH3(g)+CO2(g) 
起始浓度/ mol•Lˉ1 1.0 3.0 0 0 0
变化浓度/ mol•Lˉ1 0.5 0.5 0.5 0.5 0.5
平衡浓度/ mol•Lˉ1 0.5 2.5 0.5 0.5 0.5
K=[c(C6H5CH=CH2)•c(CO) •c(H2O)]/[c(C6H5CH2CH3) •c(CO2)]="(" 0.5×0.5×0.5)/( 0.5×2.5)=0.375。
考查方向
解题思路
(4)根据加入乙苯引起的浓度增大量与平衡移动引起的浓度减小量的相对关系分析;若实验I中将乙苯的起始浓度改为1.0mol/L,其他条件不变,因为温度不变,则K不变,根据图I中数据求出K的值.
易错点
不能灵活应用盖斯定律致错;没有理解化学平衡的特点致错;不能根据平衡时浓度进行平衡常
数的计算。
扫码查看完整答案与解析