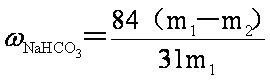- 氯碱工业
- 共13题
NaCl是一种化工原料,可以制备一系列物质(见图)。下列说法正确的是
正确答案
解析
本题考查元素化合物知识综合内容,拓展延伸至电解饱和食盐水、电解熔融氯化钠、侯氏制碱等内容,但落点很低,仅考查NaHCO3、Na2CO3的溶解度、工业制漂白粉,干燥的Cl2贮存和基本反应类型。重基础、重生产实际应该是我们高三复习也应牢记的内容。石灰乳与Cl2的反应中氯发生歧化反应,Cl2既是氧化剂,又是还原剂。常温下干燥的Cl2能用钢瓶贮存仅代表常温Cl2不与铁反应,加热、高温则不然。
知识点
右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
正确答案
解析
略
知识点
下列关于化工生产原理的叙述中,均符合目前工业生产实际的是
正确答案
解析
略
知识点
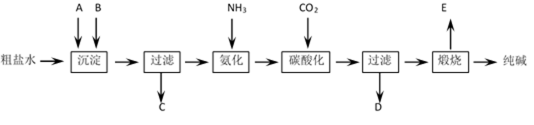
工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂)写出A、B的化学式A______________________________ B______________________________
(2)实验室提纯粗盐的实验操作依次为:
取样、__________、沉淀、__________、_________、冷却结晶、__________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是________________________________。碳酸化时没有析出碳酸钠晶体,其原因是__________________________________________。
(4)碳酸化后过滤,滤液D最主要的成分是______________________________ (填写化学式),检验这一成分的阴离子的具体方法是:____________________________________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:____________________________________________________________。
滤液D加石灰水前先要加热,原因是______________________________________________。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
______________________________________________________________________________
正确答案
(1)Ca(OH)2 或CaO Na2CO3
(2)溶解 过滤 蒸发 过滤
(3)有晶体析出(或出现浑浊) 碳酸钠溶解度比碳酸氢钠大
(4)NH4Cl 取样,加硝酸银,有白色沉淀,该阴离子是氯离子
(5)NH4+ +OH- →NH3↑ + H2O 防止加石灰水时产生碳酸钙沉淀
(6)
解析
略
知识点
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)多级闪蒸法是目前“海水淡化”的主要技术。该法是在一定条件下将海水变成蒸汽, 蒸汽经过冷却而得高纯度淡水。由此可判断多级闪蒸法是________(填“物理变化”或“化学变化”)。
(2)利用海水晒盐的原理是________;分离食盐晶体后的母液中含有KC1、MgCl2,经过分离、提纯后,可用于________。
(3)“氯碱工业”利用电解饱和食盐水制得重要化工产品。在氯碱工业中,隔膜法电解(如图甲所示)工艺逐渐被离子交换膜电解(如图乙所示)技术取代。
①写出两电极的反应式:阳极________,阴极________。
②石棉隔膜的作用是________。离子交换膜电解槽中⑥、⑦分别是________、________。
正确答案
(1)物理变化
(2)蒸发、结晶;工业上冶炼金属钾和镁
(3)①2Cl--2e-=Cl2↑;2H++2e- =H2↑;② 分成阴、阳两极室,阻止气体通过;NaOH溶液;Na+
解析
略。
知识点
扫码查看完整答案与解析