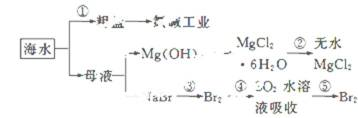
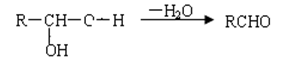- 氯碱工业
- 共13题
4.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)
下列有关说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。
18.(I)多项选择题:下列实验方案可行的是( )
A.在淀粉溶液中加稀硫酸充分反应后,再加入银氨溶液,可检验淀粉的水解产物
B.用溴水可以鉴别苯、乙醇、四氯化碳三种液体
C.除去苯中的苯酚,可加入NaOH溶液后再分液
D.将氯乙烷与NaOH的乙醇溶液共热,将产生的气体直接通入酸性高锰酸钾溶液中,溶液褪色,证明氯乙烷发生了消去反应
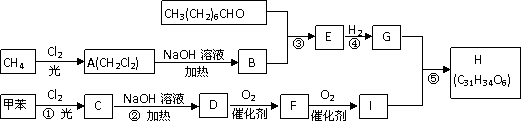
(II)一种用于治疗高血脂的新药——灭脂灵可按如下路线合成:
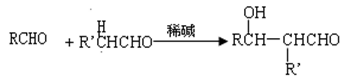
已知:①
②一个碳原子上同时连接两个羟基,立即失去一份水,生成另一种物质,如:
又知G的分子式为C10H22O3,试回答:
(1)写出D、E的结构简式:D( )E( )。
(2)B的官能团的名称( ),反应⑤的反应类型( )。
(3)CH3(CH2)6CHO有多种同分异构体, 符合下列要求的所有结构简式( )。
A.能发生银镜反应 B.烃基上的一氯取代物只有两种
(4)鉴别F和I的方法是( )
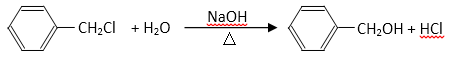
(5)反应②的化学方程式为( )。
(6)反应⑤的化学方程式为( )。
19.(I)多项选择题:下列说法中正确的是( )。
A.第一电离能由大到小的顺序为O > N > C
B.由于C22—和O22+为等电子体,所以可以判断O22+的电子式为
C.NO3—中N采用sp2杂化,故NO3—的空间构型为三角锥形
D.液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键
(II)氮元素可形成很多重要的化合物,其中叠氮化钠(NaN3)被广泛应用于汽车安全气囊。叠氮化钠的制取方法是:①金属钠与液态氨反应得NaNH2②NaNH2与N2O按物质的量2:1反应可生成NaN3、NaOH和一种气体。
(1)请写出反应②的化学方程式为:( )。
(2)与N3-互为等电子体的分子有:( )(写一种)由此可推知N3-的空间构型是:( );比较NH2-和NH3的键角∠HNH的大小:NH2-( )NH3,请用价层电子对互斥规律解释:( )。
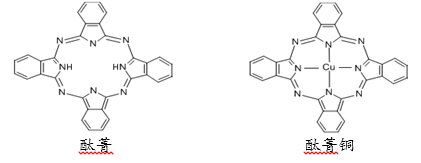
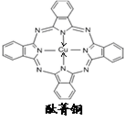
(3)氮的化合物酞箐和铜酞箐(环中含有一个铜原子)是重要的有机染料,相关分子结构如图所示:
酞箐分子中氮原子的杂化类型有:( )铜酞箐中铜原子在基态时的价电子排布式:( );请在图中用“→”标出铜酞箐中的配位键( )。
(4)小汽车的防撞气囊中叠氮化钠的工作原理是基于反应:6NaN3+ Fe2O3=3Na2O+2Fe+9N2;铁晶体有三种堆积方式,其中两种堆积方式分别如图甲、图乙所示(其晶胞特征如其右图所示):
晶胞甲中铁原子的堆积方式为:( ),晶胞乙中铁原子的配位数为:( )。铁原子半径为a cm,NA表示阿伏加德罗常数,摩尔质量为Mg/mol。则该晶体的密度可表示为:( )g/cm3。
20.(I)多项选择题:下列关于金属冶炼说法正确的是( )
A.工业上一般以铁矿石、焦炭、石灰石和空气等原料在高炉中冶炼生铁
B.炼钢主要目的是在高温下用还原剂将过多的碳和其他杂质还原成气体或炉渣除去
C.炼钢中添加硅、锰、铝等作为脱氧剂,调整钢水的成分,制成多种性能优良的钢材
D.电解铝时阴极材料需要定期更换
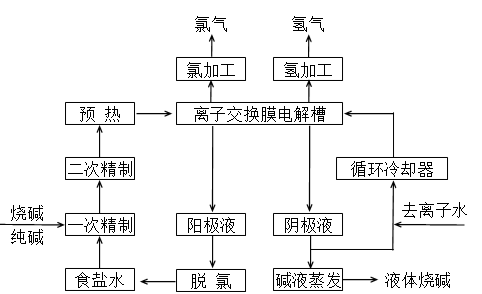
(II)氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
(1)该流程中可以循环的物质是( ) 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式( ),若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果( ) 。
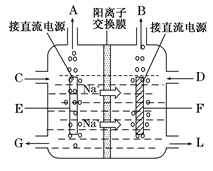
(3)图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是( ),E电极的名称是( )。电解总反应的离子方程式为( )。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为( )。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为( ) 。
正确答案
18.(I) BC(6分,答对1个得3分,答错得0分。)
(II)
(1)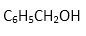
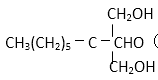
(2)醛基(1分) ; 取代反应(1分)
(3)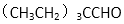
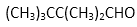
(4)把F和 I配成溶液 ,分别滴加紫色石蕊试液,如变红的是苯甲酸(即I),不变色的是苯甲醛(即F)。或者是蓝色石蕊试纸、银镜反应、新制氢氧化铜悬浊液等,其它合理均给分。(2分)
(5)
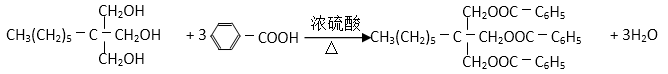
(6)
19.(I)BD(6分,答对1个得3分,答错得0分。)
(II)
(1)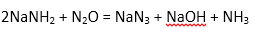
(2)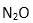
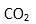
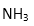
(3)
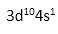
(4)体心立方堆积(1分) ; 12(1分); 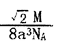
20.(I)AC(6分,答对1个得3分,答错得0分。)
(II)
(1)氯化钠 氢氧化钠 (2分)
(2)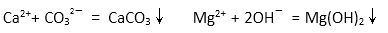
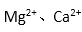
(3)
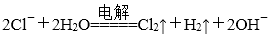
(4)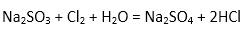
(5)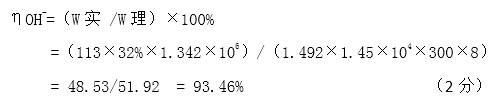
解析
解析已在路上飞奔,马上就到!
知识点
6.下列化工生产过程中不涉及氧化还原反应的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析