- 常见有机化合物的结构
- 共41题
4.化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:
有关上述曲线图的说法正确的是( )
正确答案
解析
A选项由图象可知,V正减小,V逆增大,故不可能是由于改变温度引起,改变温度正逆反应速率将同时增大或减小,故A错;
B选项纵坐标为PH值,横坐标为所加NaOH溶液体积,滴加过程中酸碱中和,PH值逐渐增大,接近终点时溶液由酸性变中性然后碱性(PH表现为突变),故B正确;
C选项明矾溶液为KAl(SO4)2溶液,滴加Ba(OH)2过程先产生Al(OH)3和BaSO4两种沉淀,随后只有Al(OH)3溶于过量的碱,故C图错;
D选项大多数固体的溶解度随温度升高而增大,少部分除外,如:Ca(OH)2,故D错
考查方向
解题思路
①改变温度可逆反应正逆反应速率同时增大或减小。
②酸中滴碱,溶液的PH值逐渐增大,快接近滴定终点时PH值会突变。
③明矾溶液中滴加Ba(OH)2除了产生Al(OH)3沉淀还有BaSO4沉淀,后者不会溶于过量的碱。
④大多数固体的溶解度随温度升高而增大,少部分除外,如:Ca(OH)2。
易错点
不分析图中横纵坐标含义及特殊的点和曲线的变化趋势所代表的含义就盲目解答。
知识点
10.铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
(1)操作a的名称为 。
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式 。
(3)写出加入30%H2O2过程中发生的离子反应方程式: 。
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是: 。
(5)在废液中加入10%明矾溶液发生反应的离子方程式为 。
(6)由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+
①请分析电解过程中溶液pH不断上升的原因 。
②当电路中通过3mol电子时,理论上可还原
正确答案
(1)过滤
(2)Fe2O3+6H+=2Fe3++3H2O
(3)2CrO2—+ 3
(4)取上层清液,向其中再加入Pb(NO3)2溶液,若无沉淀产生,证明沉淀完全,否则未沉淀完全;
(5)SO42-+Pb2+=PbSO4↓;
(6)①电解时阴极消耗氢离子,亚铁离子还原Cr2O72-消耗氢离子,所以pH不断上升; ②0.25
解析
(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;由流程图可知,操作a是把溶液与不溶物分离,应是过滤;
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式Fe2O3+6H+=2Fe3++3H2O
(3)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水,反应离子方程式为3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;故答案为:3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
(4)检验沉淀是否完全的方法是:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;故答案为:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
(5)废液中含有Pb(NO3)2,废液中加入10%明矾溶液目的是将Pb2+转化为PbSO4沉淀,反应方程式为2Pb(NO3)2+KAl(SO4)2=2PbSO4↓+KNO3+Al(NO3)3;在废液中加入10%明矾溶液发生反应的离子方程式为SO42-+Pb2+=PbSO4↓
(6)①请分析电解过程中溶液pH不断上升的原因:电解时阴极消耗氢离子,亚铁离子还原Cr2O72-也消耗氢离子,所以pH不断上升;
②当电路中通过3mol电子时,理论上可还原
考查方向
本题主要考查了制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用。
解题思路
(1)将铬污泥粉碎,可以增大反应物的接触面积,加快反应速率。二氧化硅不溶于盐酸,所以通过过滤进行分离。
(2)双氧水具有氧化性,能把CrO2—氧化生成CrO42—。
(3)如果沉淀不完全,则溶液中还含有CrO42—,继续滴加Pb(NO3)2溶液会继续生成沉淀,据此进行检验。
(4)明矾和硝酸铅反应生成硫酸铅沉淀。
易错点
离子的检验及(4)题中化学语言的正确运用,为易错点。
知识点
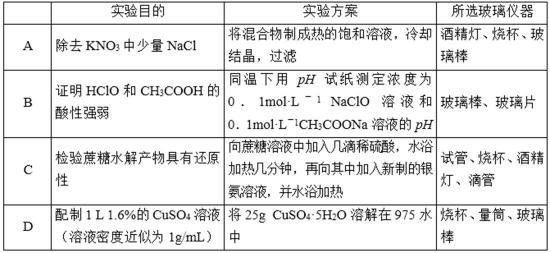
4.用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是 ()
正确答案
解析
A.过滤时还需要用漏斗,该实验中没有漏斗,故A错误;
B.NaClO具有强氧化性,不能用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH,则不能确定pH大小,不能比较酸性的强弱,故B错误;
C.银镜反应需要在碱性条件下进行,所以在加入银氨溶液之前需要加入NaOH溶液中和未反应的酸,故C错误;
D.1L 1.6%的CuSO4溶液(溶液密度近似为1g/mL)中溶质的物质的量是0.1mol,溶液的质量是1000g,25g CuSO4•5H2O中硫酸铜的物质的量是0.1mol,故D正确。
本题正确答案是D
考查方向
本题考查了实验方案评价,明确实验原理是解本题关键,题目难度不大,注意不能用pH试纸检验次氯酸钠溶液的pH大小。
解题思路
A.过滤时还需要用漏斗;
B.NaClO具有强氧化性,不能用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH;
C.银镜反应需要在碱性条件下进行;
D.1L 1.6%的CuSO4溶液(溶液密度近似为1g/mL)中溶质的物质的量是0.1mol.
易错点
因为次氯酸具有漂白性,易错选项是B.
知识点
6.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
正确答案
解析
A选项根据一般活泼金属作负极,故Mg为负极,石墨为正极,故A错;
B选项正极反应为:H2O2+2e-=2OH-,即双氧水得电子发生还原反应,故B错;
C选项由之前反应可知生成正极OH-,PH增大,故C正确;
D选项正极带负电吸附阳离子,Cl-带负电往负极移动,故D错。
考查方向
解题思路
①一般活泼金属作负极。
②正极得电子,发生还原反应,负极失电子,发生氧化反应。
③H2O2具有氧化性,得电子生成OH-,碱性增强。
④原电池电解质溶液中,阳离子往正极移动,阴离子往负极移动。
易错点
正负极的判断,溶液中阴阳离子移动方向。
知识点
4.
正确答案
解析


考查方向
解题思路
先书写
易错点
同分异构体的数量计算。
知识点
扫码查看完整答案与解析