- 电子式、化学式或化学符号及名称的综合
- 共24题
下列有关化学用语使用正确的是( )
正确答案
解析
A选项中的Br-漏掉了8个电子,应为
知识点
前四周期原子序数依次增大的元素A,B,C,D中, A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1) D2+的价层电子排布图为_______。
(2) 四种元素中第一电离最小的是________,
电负性最大的是________。(填元素符号)
(3) A、B和D三种元素责成的一个化合物的晶胞如图所示。
① 该化合物的化学式为_________;D的配位数为_______;
② 列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,期中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
正确答案
答案:
(1)
(2)K F
(3)①K2NiF4; 6
②=3.4
(4)离子键、配位键;[FeF6]3-;
解析
略
知识点
下列有关化学用语能确定为丙烯的是
正确答案
解析
A项有可能为硅的氢化物Si3H6,也可能是卤素代物,B项可能是环丙烷,C项缺少一个氢原子。
知识点
工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式________,属于弱酸的电离方程式________。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是________(选填编号)。
a. 气态氢化物的稳定性
b. 最高价氧化物对应水化物的酸性
c. 单质与氢气反应的难易
d. 单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为________。
(4) Na2CO3俗称纯碱,属于________晶体。工业上制取纯碱的原料是________。
正确答案
(1)

(2)ac
(3)Al(OH)3+OH-=AlO2- +2H2O
(4)离子晶体;氯化钠;二氧化碳;氨
解析
(1)HF、H2O属于极性分子,CO2属于非极性分子;HF属于弱酸,Al(OH)3属于两性氢氧化物。
(2)O、F两种元素在周期表中位置相邻,由于二者均无最高价氧化物对应的水化物,且二者属于非金属,单质不与酸反应,故比较非金属性强弱的依据为a、c。
(3)Na与Al处于同一周期,由于Al(OH)3属于两性氢氧化物,因而它能与强碱氢氧化钠反应。
(4)碳酸钠属于离子晶体,工业常利用侯氏制碱法制备:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ②2NaHCO3(加热)=Na2CO3+H2O+CO2↑故常用原料为NaCl、NH3、CO2。
知识点
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题:
(1)元素Z位于周期表中第__________周期,__________族;
(2)这些元素的氢化物中,水溶液碱性最强的是__________(写化学式);
(3)XW2的电子式为__________;
(4)Y的最高价氧化物的化学式为__________;
(5)W和Y形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为__________。
正确答案
(1)三,VA族;
(2)NH3;
(3)
(4)N2O5;
(5)S4N4
解析
由题干先推导出Z元素为磷元素,则X、Y、W分别是C、N、S。(3)小题的电子式教材中没有,得由二氧化碳的结构类比而来。(5)小题中计算为N(S):N(N)=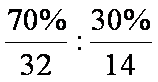
知识点
扫码查看完整答案与解析












