- 水的电离
- 共35题
下图表示氮及其化合物在一定条件下的转化关系:
16.反应I:N2(g)+3H2(g)
17.① 反应II的化学方程式是_______。② 反应II其中一步反应为2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJ•mol-1
已知:
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为_______ kJ。
18.反应III是利用右图所示装置电解制备NCl3(氯的化合价为+1),其原理是:
NH4Cl+2HCl
① b接电源的_______极(填“正”或“负”)。
② 阳极反应式是_______。
19.反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是_______。
正确答案
压强 L1<L2 合成氨的反应是放热反应,压强相同时,温度升高,平衡逆向移动,氨的体积分数减小
解析
根据气体分子系数的变化判断,NH3的体积分数随着压强增大而增大,根据反应为放热反应判断,NH3的体积分数随着温度增大而减小,结合图像,得到X为压强;同样压强下,L1的NH3的体积分数大于L2,所以L2>L1。
2Cl(g)
2N(g)
考查方向
解题思路
根据混合气中NH3的体积分数随温度或压强变化的曲线,判断各字母所代表的实际意义;再根据原电池与电解池的构成判断正负极以及书写化学方程式
易错点
电解池的正负极判断以及正负极反应方程式的书写
正确答案
① 8NH3 +3Cl2=N2 +6NH4Cl
② 41
解析
根据转化关系判断,反应物为NH3和Cl2,生成物为NH4Cl和N2。根据得失电子守恒
完成配平。
考查方向
解题思路
根据混合气中NH3的体积分数随温度或压强变化的曲线,判断各字母所代表的实际意义;再根据原电池与电解池的构成判断正负极以及书写化学方程式
易错点
电解池的正负极判断以及正负极反应方程式的书写
正确答案
① 负
② 3Cl-﹣6e-+NH4+=NCl3+4H+
解析
①b电极H+反应生成H2,得电子,所以b电极为阴极,连接电源的负极。②阳极反应物为NH4Cl,生成物为NCl3(题目中给出氯为+1价),其中氯失电子升价,氮、氢不变价。根据电荷守恒配平方程式。
考查方向
解题思路
根据混合气中NH3的体积分数随温度或压强变化的曲线,判断各字母所代表的实际意义;再根据原电池与电解池的构成判断正负极以及书写化学方程式
易错点
电解池的正负极判断以及正负极反应方程式的书写
正确答案
NCl3+6ClO2-+3H2O=6ClO2+NH3+3Cl-+3OH-
解析
根据题意,已知反应物含有NCl3、2ClO,生成物含有ClO2、NH3,由质量守恒得到
反应物中需要有氢,考虑是H2O或者H+,由于生成NH3,推测环境为碱性,反应物为H2O,生成物为OH-。
考查方向
解题思路
根据混合气中NH3的体积分数随温度或压强变化的曲线,判断各字母所代表的实际意义;再根据原电池与电解池的构成判断正负极以及书写化学方程式
易错点
电解池的正负极判断以及正负极反应方程式的书写
6.下列说法错误的是( )
正确答案
解析
A、根据物料守恒,
B、KHA溶液的pH=10,说明HA-的水解程度大于电离程度,c(K+)>c(HA-)>c(OH-)>c(A2-);。
C、由于c(CH3COO-)+c(OH-)=c(Na+)+c(H+),中性时,c(CH3COO-)=c(Na+),所以c(CH3COO-)+c(CH3COOH)>c(Na+);。
D、由于Cl-浓度,CaCl2溶液中大,所以AgCl在CaCl2溶液中的溶解度小。
考查方向
解题思路
A、根据物料守恒判定。
B、HA-的水解程度大于电离程度;
C、根据c(CH3COO-)+c(OH-)=c(Na+)+c(H+)判断;
D、由于Cl-浓度,CaCl2溶液中大,所以AgCl在CaCl2溶液中的溶解度小。
易错点
HA-同时发生水解和电离。
知识点
5.如图所示为全钒液流电池的结构图。全钒液流电池体系包括两个分别装着同种金属不同价态的离子组成的氧化还原对的电解液槽、两个离心泵和一个钒电池组成。钒电池把能量储存在V(II)/V(III)硫酸溶液和V(IV)/V(V)硫酸溶液中。在离心泵机械传动下,储液罐中的电解液被压入电池堆体内,同时发生电化学反应,接着电解液又再次回到储液槽中,按照此种方式进行循环流动以完成化学能与电能的相互转换,下列说法不正确的是( )
正确答案
解析
A.钒是一种过渡元素,原子序数为23,位于元素周期表中d区,第四周期第VB族,A错误;
B.原电池放电时阳离子向正极迁移,H+向正极室迁移,起到了正极室与负极室的导电的作用,B正确;
C.原电池工作时,在正极表面V5+得到电子变成V4+ ,在负极表面V2+失去电子变成V3+,C正确;
D.原电池工作时,V2+失去一个电子变成V3+,V5+得到一个电子变成V4+,消耗的V2+和V5+的物质的量之比为1∶1,D正确;
故选A。
考查方向
解题思路
A.钒位于元素周期表中d区,第四周期第VB族;
B.原电池放电时阳离子向正极迁移;
C.原电池工作时,在正极表面V5+得到电子变成V4+ ,在负极表面V2+失去电子变成V3+;
D.原电池工作时,V2+失去一个电子变成V3+,V5+得到一个电子变成V4+;
易错点
本题从两个角度考查①原电池反应(反应原理、电极方程式、离子的移动方向);②有关化学方程式的计算。
知识点
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义。
15.NO可通过氧化-还原法转化为N2,转化关系如下:
反应Ⅰ的化学方程式是_______;反应Ⅱ的还原剂是_______。
16.NO还可与C在一定条件下反应得到无污染的气体。NO与C在一定条件下反应的化学方程式是_______。
17.NO也可直接用活性铁粉转化为N2。
已知:N2(g)+O2(g)=2NO(g) △H1 4Fe(s)+3O2(g)=2Fe2O3(s) △H2
则6NO(g)+4Fe(s)=2Fe2O3(s)+3N2(g) △H =_______(用“△H1”、“△H2”表示)。
18.NO2可电解制备绿色硝化试剂N2O5。下图是其原理示意图。

正确答案
2NO +O2=2NO2 CO(NH2)2
解析
NO与氧气反应生成NO2,方程式为2NO+O2=2NO2,NO2具有氧化性,CO(NH2)2与发生氧化还原反应生成氮气CO(NH2)2为还原剂,故答案为:2NO+O2=2NO2;CO(NH2)2
考查方向
本题考查了氧化剂与还原剂的知识点
解题思路
NO与氧气反应生成NO2,NO2具有氧化性,CO(NH2)2与发生氧化还原反应生成氮气
易错点
易错点是混淆还原剂的概念。还原剂具有还原性,本身被氧化,组成的某种元素的化合价由低到高。
教师点评
本题考查了氧化剂与还原剂的知识点,在近几年的各省高考题出现的频率非常高。
正确答案
解析
NO还可与C在一定条件下反应得到无污染的气体,应生成氮气和二氧化碳,方程式为2NO+C═N2+CO2,故答案为:2NO+C═N2+CO2
考查方向
本题考查了书写化学方程式的能力
解题思路
NO还可与C在一定条件下反应得到无污染的气体,应生成氮气和二氧化碳
易错点
注意反应的条件不要漏写。
教师点评
本题考查了书写化学方程式 的能力,在近几年的各省高考题出现的频率非常高。
正确答案
△H2-3△H1
解析
已知①N2(g)+O2(g)=2NO(g)△H1②4Fe(s)+3O2(g)=2Fe2O3(s)△H2,利用盖斯定律将②-①×3可得6NO(g)+4Fe(s)=2Fe2O3(s)+3N2(g),则△H=△H2-3△H1,故答案为:△H2-3△H1
考查方向
本题考查了有关热化学方程式的知识
解题思路
已知①N2(g)+O2(g)=2NO(g)△H1②4Fe(s)+3O2(g)=2Fe2O3(s)△H2,利用盖斯定律将②-①×3可得6NO(g)+4Fe(s)=2Fe2O3(s)+3N2(g)
易错点
注意盖斯定律的应用
教师点评
本题考查了有关热化学方程式的知识,在近几年的各省高考题出现的频率非常高。
正确答案
① 2NO2(g) 
给1分)③ N2O4(也可写成NO2)
解析
①2NO2(g)⇌N2O4(g)△H<0,降低温度向吸热方向移动,即降低温度向生成N2O4的方向移动,
故答案为:2NO2(g)⇌N2O4(g)△H<0,在其他条件不变时,降温平衡右移,有利于NO2转化为N2O4;
②NO2可电解制备绿色硝化试剂N2O5,N元素化合价升高,NO2被氧化,电极方程式为N2O4-2e-+2HNO3=2N2O5+2H+,故答案为:N2O4-2e-+2HNO3=2N2O5+2H+;
③阳极上N2O4放电生成N2O5,电极反应为N2O4-2e-+2HNO3=2N2O5+2H+,阴极发生2NO3-+2e-+4H+=N2O4+2H2O,则循环使用的物质为N2O4,
故答案为:N2O4
考查方向
本题考查了电解池和化学反应平衡的知识
解题思路
NO2可电解制备绿色硝化试剂N2O5.N元素化合价升高,NO2被氧化,为电解池阳极反应,阴极浓硝酸被还原生成N2O4
易错点
注意电极方程式的书写。
教师点评
本题考查了电解池和化学反应平衡的知识,在近几年的各省高考题出现的频率非常高。
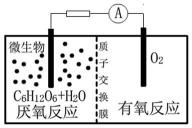
12.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
正确答案
解析
燃料电池中O2得电子在正极反应, C6H12O6失电子在负极上反应
A.通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,故A正确;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故B正确;
C.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O,因此CO2在负极产生,故C错误;
D.该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O,故D正确;
考查方向
本题考查原电池原理
解题思路
燃料电池中O2得电子在正极反应, C6H12O6失电子在负极上反应:
A.原电池中,阳离子向正极移动,所以质子通过交换膜从负极区移向正极区;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池;
C.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O;
D.燃料电池反应式和燃料燃烧方程式相同
易错点
电极反应式,根据氧化还原中的得失电子分析
教师点评
本题考查原电池原理,在近几年的各省高考题中出现的频率非常高
知识点
扫码查看完整答案与解析