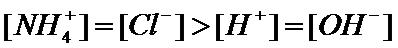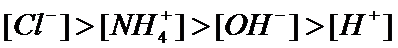- 电解质溶液的导电性
- 共60题
21.某溶液中只含有四种离子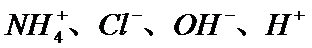
正确答案
解析
溶液中只含有四种离子NH4+、Cl-、OH-、H+,溶质可能为①氯化铵、②氯化铵与氯化氢、③氯化铵与一水合氨,溶液可能为酸性、中性或碱性,
若溶质为NH4Cl时,铵根离子水解方程式为NH4++H2O
若溶质为氯化铵和一水合氨时,当溶液呈中性时,则[H+]=[OH-]、[NH4+]=[Cl-];当一水合氨稍过量,溶液呈碱性时,[NH4+]>[Cl-]>[OH-]>[H+];
若溶质为氯化铵和氯化氢时,当氯化氢过量,溶液溶液呈酸性时,则[Cl-]>[NH4+]>[H+]>[OH-],
A.当溶质为氯化铵和一水合氨时,溶液呈碱性,[OH-]>[H+],根据电荷守恒可知[NH4+]>[Cl-],所以可以满足[NH4+]>[Cl-]>[OH-]>[H+],故A正确;
B.溶质为氯化铵和一水合氨,且溶液呈中性时,则[H+]=[OH-]、[NH4+]=[Cl-],可以满足[NH4+]=[Cl-]>[H+]=[OH-],故B正确;
C.溶液中一定满足电荷守恒,而[Cl-]>[NH4+]>[OH-]>[H+]不满足电荷守恒,故C错误;
D.[OH-]>[NH4+]>[H+]>[Cl-]中,无论溶质为氯化铵还是氯化铵与氯化氢或氯化铵与一水合氨,若[OH-]>[H+],说明溶液呈碱性,则一水合氨过量,则溶质为氯化铵和一水合氨,但是氢离子浓度最小,应该满足[H+]<[Cl-],故D错误
考查方向
离子浓度大小的比较
解题思路
液中只含有四种离子NH4+、Cl-、OH-、H+,溶质可能为①氯化铵、②氯化铵与氯化氢、③氯化铵与一水合氨,溶液可能为酸性、中性或碱性,结合电荷守恒、物料守恒及盐的水解原理进行讨论各离子浓度大小
易错点
相同的溶质组成中由于量的不同而离子浓度的大小顺序不同
教师点评
本题考查了离子浓度大小比较,题目难度中等,根据溶液中存在离子正确判断溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法,试题培养了学生的分析能力及灵活应用能力
知识点
14.有关右图的说法正确的是
正确答案
解析
在用铁片、铜片和稀硫酸组成的原电池装置中,铁片的活泼性大于铜片的活泼性,所以铁片作负极,铜作正极;
A.构成原电池时,电子是从负极铁通过导线流到正极铜片上,不能经过溶液,故A错误;
B.构成原电池时溶液中阴离子从正极移向负极,则溶液中SO42-离子移向铁片,故B错误;
C.要使Fe片不被腐蚀,应让铁片作原电池正极或电解池阴极,可将铜片换成锌片或将铁片直接接直流电源负极,故C错误;
D.要在铁片上镀一层薄薄的铜,在Cu片上反应为:Cu-2e→Cu2+,故D正确
考查方向
电化学
解题思路
在用铁片、铜片和稀硫酸组成的原电池装置中,铁片的活泼性大于铜片的活泼性,所以铁片作负极,负极上铁失电子发生氧化反应,铜片作正极,正极上氢离子得电子发生还原反应,电子是从负极铁通过导线流到正极铜片上,溶液中阴离子从正极移向负极,要使Fe片不被腐蚀,应让铁片作原电池正极或电解池阴极
易错点
电子不经过溶液
教师点评
本题综合考查了原电池的反应原理,金属腐蚀,电镀,为高频考点,侧重于基本理论知识的考查,题目涉及电子流向、离子移动方向的判断,难度不大
知识点
15.CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法错误的是
正确答案
解析
A.滴加KI溶液时,I元素的化合价升高,KI被氧化,Cu元素的化合价降低,则CuI是还原产物,故A正确;
B.通入SO2后溶液逐渐变成无色,发生了氧化还原反应,S元素的化合价升高,体现其还原性,故B正确;
C.2CuSO4+4KI═2K2SO4+2CuI↓+I2反应中Cu元素的化合价降低是氧化剂,I2是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,所以物质的氧化性:Cu2+>I2,SO2+2H2O+I2=H2SO4+2HI中碘元素化合价由0价降低为-1价,I2是氧化剂,SO2被氧化,所以物质氧化性I2>SO2,所以氧化性Cu2+>I2>SO2,故C正确;
D.发生2CuSO4+4KI═2K2SO4+2CuI↓+I2、SO2+2H2O+I2=H2SO4+2HI均为氧化还原反应,没有复分解反应,故D错误;
考查方向
氧化还原反应
解题思路
CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,反应中Cu元素的化合价降低,I元素的化合价升高;向反应后的混合物中不断通入SO2气体,反应方程式为SO2+2H2O+I2=H2SO4+2HI,该反应中S元素的化合价升高,I元素的化合价降低,以此来解答
易错点
由信息推断两氧化还原反应
教师点评
本题考查氧化还原反应,根据题目信息推断实验中发生的反应,素材陌生,难度较大
知识点
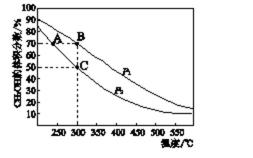
7.CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)

正确答案
解析
A.由300℃时,增大压强,平衡正向移动,CH3OH的体积分数增大,所以p1>p2,故A错误;
B.图可知,升高温度,CH3OH的体积分数减小,平衡逆向移动,则该反应的△H<0,故B错误;
C.A、B处的温度不同,平衡常数与温度有关,故平衡常数不等,故C错误;
D.设向密闭容器充入了1molCO和2molH2,CO的转化率为x,则
CO(g)+2H2(g)⇌CH3OH(g)
起始 1 2 0
变化 x 2x x
结束 1-x 2-2x x
在C点时,CH3OH的体积分数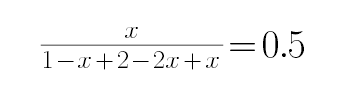
考查方向
化学平衡
解题思路
A.温度升高、增大压强均使该反应的化学反应速率加快;
B.由图可知,升高温度,平衡逆向移动,说明该反应的△H<0;
C.平衡常数只与温度有关;
D.设向密闭容器充入了1molCO和2molH2,利用三段法进行数据分析计算
易错点
定一议二图像分析法
教师点评
本题考查了图象和化学平衡的关系,,难度中等,重在培养学生图象与化学平衡理论的相互关系
知识点
7. 30℃时,利用右图装置进行实验,结果记录如下表所示:
下列说法不正确的是
正确答案
解析
A.Ⅱ中铝比铁活泼,铝与稀硫酸反应生成氢气,其电极反应是:Al-3e-═Al3+,故A正确;
B.III中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行,故B正确;
C.Ⅳ中Fe溶解,为负极,发生了氧化反应,故C正确;
D.上述实验表明:相同条件下,Al在浓HNO3中更稳定,Fe在浓H2SO4中更稳定,故D错误
考查方向
电化学
解题思路
A.Ⅱ中铝比铁活泼,铝与稀硫酸反应生成氢气,其电极反应是:Al-3e-═Al3+;
B.III中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行;
C.Ⅳ中Fe溶解,为负极,发生了氧化反应;
D.上述实验表明:相同条件下,Al在浓HNO3中更稳定,Fe在浓H2SO4中更稳定
易错点
III、Ⅳ中金属稳定性的判断
教师点评
本题考查原电池工作原理,为高频考点,题目难度中等,侧重于学生的分析能力的考查,明确原电池工作原理,注意掌握原电池的工作原理以及电极方程式的书写方法,要具体问题具体分析
知识点
扫码查看完整答案与解析