- 分子间作用力
- 共6题
下列说法正确的是:
正确答案
解析
惰性气体组成的晶体中不含化学键,只含有分子间作用力,A项正确。1分子能电离出两个H+ 的酸才是二元酸,如CH3COOH分子中含有4个H,却是一元酸,B项错误。AlCl3晶体中含有金属阳离子,但是分子晶体,C项错误。氮元素的非金属性较强,但N2很稳定,故D项错误。
知识点
下列变化需克服相同类型作用力的是
正确答案
解析
略
知识点
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2 
①上述化学方程式中的5种物质所属的晶体类型有 (填序号)。
a。离子晶体 b。分子晶体 c,原子晶体 d。金属晶体
②基态铜原子的核外电子排布式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
①晶体Q中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(4)已知苯酚(

正确答案
见解析。
解析
(1)
(2)①a、b、d ②1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)①a、d ②三角锥型 sp3
(4)< 
知识点
下表为周期表的一部分,其中的编号代表对应的元素。试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图: 。
元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有 。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为 。
②该化合物的晶体中存在的作用力有 。
A.离子键 B.极性键 C.非极性键 D.范德华力 E.氢键 F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为 。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是 。
正确答案
(1)1s22s22p63s23p63d54s1(或[Ar]3d54s1) 
(2)CD
(3)①分子晶体 ②BDF ③1∶2
(4)氟化氢气体中存在因氢键而相互缔合形成的缔合分子(HF)n
(5)Be与Al在元素周期表中位于对角线的位置
解析
略
知识点
(1)元素的第一电离能:AI Si(填“>”或:“<”)
(2)基态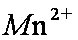
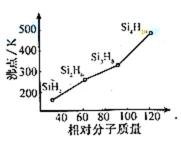
(3)硅烷(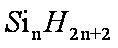
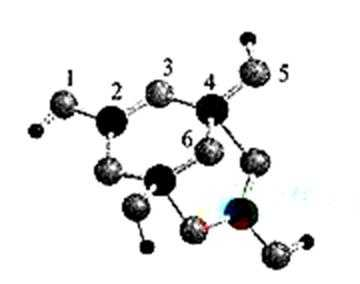
(4)硼砂是含结晶水的四硼碳酸,其阴离子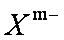
①在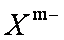
②鹏砂晶体由
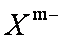
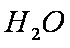
a离子键
b共价键
c金属键
d范德华力
e氢键
正确答案
见解析。
解析
(1)<
(2)1s22s22p63s23p23d5 或[Ar]3d5
(3)硅烷属于分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高
(4)①sp2 sp3 4.5 2
B周围有3个σ键时为sp2杂化;B周围有4个σ键时为sp3杂化(其中有一个键是配位键),一个B原子形成一个配位键后化合价降低一个单位;4号碳含有4个σ键(其中5号氧原子提供孤对电子,与4号碳形成配位键),该阴离子中共有2个B原子是sp3杂化,阴离子的化合价为-2价。
②ADE
硼砂晶体含金属离子(钠离子),属于离子晶体,含有离子键,水分子内部含有共价键,水分子的氧原子和硼砂晶体的氢原子可形成氢键
知识点
扫码查看完整答案与解析