- 化学综合计算
- 共266题
intend
正确答案
honey
正确答案
4.Fe2O3.CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到金属混合物4.82g,将生成的CO2气体用足量的澄清石灰水吸收后,产生l0.00g白色沉淀,则a的数值为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
30.某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:
(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有________、________。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是________(填下列各项中序号)。
②CuCl2溶液中存在如下平衡:
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是________(填下列各项中序号)。
a.FeCl3固体
b.CuCl2固体
c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为:
第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为 _______________。
②300~400oC范围内,固体质量明显增加的原因是________,上图所示过程中,CuSO4固体能稳定存在的阶段是_____(填下列各项中序号)。
a.一阶段 b.二阶段
c.三阶段 d.四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。
a.装置组装完成后,应立即进行的一项操作是________。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为________溶液。
c.若原CuS矿样的质量为10.0 g,在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.0 g,则原矿样中CuS的质量分数为________。
正确答案
(1)胶头滴管 500ml容量瓶
(2)cd c
(3)
①
②Cu2S转化为CuSO4固体质量增加 c
③
a.关闭分液漏斗活塞,在D中加水至淹没下端管口,微热A中圆底烧瓶看到D中有气泡冒出,停止微热后导管中有一小段水柱回流,则气密性好
b.BaCl2或其他合理答案
c.96.0﹪
解析
解析已在路上飞奔,马上就到!
知识点
10、在硫酸铁溶液中,加入a g 铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
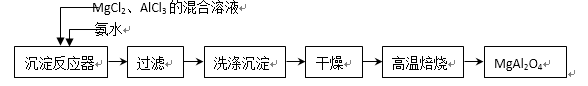
25.实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4 主要流程如下:
⑴制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式( )。
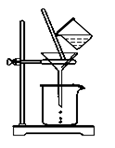
⑵如图所示,过滤操作中的一处错误是 ( )。
判断流程中沉淀是否洗净所用的试剂是( )。高温焙烧时,用于盛放固体的仪器名称是( ) 。
⑶在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式( )
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10 -34。)
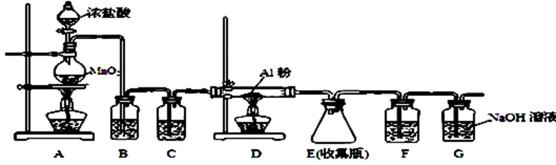
⑷无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是( );
F中试剂的作用是 ( );用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为( )。
⑸将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 ( ) g。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.某混合气体X,可能由H2、C0、C02和水蒸气中一种或几种组成,现将混合气体通入灼热 CuO,完全反应后,固体CuO质量减少1.6g;再将反应后的混合气体全部导入足量的澄淸 石灰水中,生成白色沉淀10g。根据以上信息,分析下列有关X的组成推断正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.将Mg、Cu组成的2.64g混合物投入适量稀稍酸中恰好完全反应,并收集还原产物气体NO(还原产物只有一种)。然后向反应后的溶液中加入一定浓度的氢氧化钠溶液,使金属恰好沉淀完全,此时生成沉淀的质量为4.68g,则反应过程中收集到NO气体(标况下)体积为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引。查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成及含量,他们进行如下实验。
一.定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有( )。
(2)热还原法检验:按下图装置连接好仪器(图中夹持设备已略去),检查装置的气密性。往装置中添加药品。打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯。
请回答下列问题:
①检查装置A气密性的方法是 ( )。
②B中试剂的名称是( )。
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是( )。
(3)某同学也设计一个实验方案来探究黑色粉末是否含Fe3O4 :取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴人KSCN溶液,观察现象。请分析此方案是否可行,并解释原因。答:( )。
二.沉淀法定量测定
按如下实验流程进行测定。
(4)操作II的名称是( )、( )、转移固体。
(5)通过以上数据,计算黑色粉末中各组分的质量分别为( ) 。
25.某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引。查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4。为进一步探究黑色粉末的组成及含量,他们进行如下实验。
正确答案







正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析