- 化学综合计算
- 共266题
13.常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
正确答案
解析
A.体积图象可知b点溶液pH=7,此时HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,铵根离子与R-的水解程度相等,故A错误;B. a~b点导电能力增强,说明反应后溶液中离子浓度增大,也证明HR在溶液中部分电离,为弱酸,故B正确;C.根据图象可知,c点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-),故C正确;D.常温下水的离子积为:KW=c(H+)×c(OH-)=1.0×10-14,由于b-c点溶液的反应温度相同,则水的离子积不变,故D正确;
本题正确答案是A
考查方向
解题思路
A.b点溶液pH=7,此时加入10mLHR,HR与一水合氨的浓度、体积相等,则二者恰好反应; B.根据图象可知,a~b点导电能力增强,说明HR为弱电解质,在溶液中部分电离,加入氨水后生成强电解质,离子浓度增大;C.c点时溶液的pH>7,混合液显示碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-);D.b-c点,溶液的温度不变,则水的离子积不变.
易错点
离子浓度定性比较、溶液酸碱性与溶液pH的计算
知识点
20.相同状况下,pH=2的两种一元酸HX和HY的溶液分别取50mL,加入足量的表面积相同的镁粉,充分反应后,收集H2的体积(同温同压下)V(HX)>V(HY),下列说法正确的是
正确答案
解析
根据题意不难分析,两种酸已经全部反应完全,但是产生的气体体积V(HX)>V(HY),这说明HX所提供的氢离子大于HY,有由于初始PH相等,因而能充分说明HX没有完全电离,即为弱酸,但不能说明HY为强酸,且HX酸性弱于HY。
A.由于HX酸性更弱,水解程度更大,同等条件下碱性更强,故错误。C.反应开始之后,弱酸的反应速率快,所用时间不相同,故错误。
考查方向
解题思路
强电解质与弱电解质的本质区别在于是否完全电离
易错点
弱酸的电离平衡于PH,弱电解质的电离平衡移动
知识点
13.已知:2C(s)+O2(g)=2CO(g) ΔH=-217kJ·mol-1C(s)+H2O(g)=CO(g)+H2(g) ΔH=b kJ·mol-1H-H、O-H和O=O键的键能分别为436、462和495kJ·mol-1,则b为
正确答案
解析
①2C(s)+O2(g)=2CO(g) ΔH1=-217kJ·mol-1
②C(s)+H2O(g)=CO(g)+H2(g) ΔH2=b kJ·mol-1
H-H、O-H和O=O键的键能分别为436、462和495kJ·mol-1,
由②×2 - ①得:
③2H2O(g)=2H2(g)+O2(g) ΔH3=2ΔH2-ΔH1=(2b+217)kJ·mol-1
由【微观角度ΔH=E反应物总键能 - E生成物总键能】可知:
ΔH3=2b+217=4×462-(2×436+495),不难求出b值。
考查方向
热化学方程式的应用,盖斯定律的理解。
解题思路
又已知热化学方程式,推导出待求的热化学方程式,由给出的焓变,通过盖斯定律可以推导出来。ΔH有两种算法:
(1)宏观角度ΔH=E生成物 - E反应物;
(2)微观角度ΔH=E反应物总键能 - E生成物总键能。
易错点
微观角度求焓变时,反应物与生成物键能弄反了,或者化学键的个数计算错误。
教师点评
ΔH=E反应物总键能 - E生成物总键能有同学记不住这个公式。
知识点
1.化学与生活密切相关,下列说法正确的是()
正确答案
解析
A、绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染,而不是产生污染再治理,故A错误;
B、钙不是微量元素,钙在人体内是常量元素,故B错误;
C、食盐可以做食品的防腐剂,如用食盐来腌制食品能防止腐烂,故C错误;
D、“地沟油”的成分是油脂,可用来制肥皂和生物柴油,故D正确;
考查方向
解题思路
A、绿色化学的核心是提高原子利用率减少污染;
B、钙不是人体必不可少微量元素;
C、食盐具有咸味,常用作调味品和防腐剂;
D、“地沟油”的成分是油脂.
易错点
人体必不可少的微量元素; 食盐作食品防腐剂。
知识点
22.在含有2mol复盐NH4Al(SO4)2的溶液中加
正确答案
解析
2mol复盐NH4Al(SO4)2的溶液中电离产生2molNH4+、2molAl3+和4molSO42-,设加入氢氧化钡为xmol,当铝离子未完全沉淀,所以沉淀的质量为: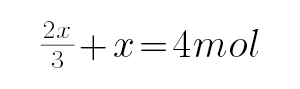
考查方向
化学方程式的计算
解题思路
两溶液混合,发生反应Ba2++SO42-=BaSO4↓,同时发生Al3++OH-=Al(OH)3↓,当Al3+反应完了,OH-再和NH4+反应:NH4++OH-=NH3•H2O,根据硫酸钡求出Ba2+的物质的量,进而计算出加入的OH-总量,再计算出Al3+完全反应消耗OH-的物质的量,根据离子方程式计算生成Ba(OH)2的物质的量
易错点
Al3+和NH4+与OH-离子反应顺序
教师点评
本题考查化学方程式有关计算,为高频考点,明确离子反应先后顺序及氢氧化铝性质是解本题关键
知识点
过氧化钠是一种淡黄色固体,有漂白性,能与水、酸性氧化物和酸反应。
54.一定条件下,m克的H2、CO的混合气体在足量的氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重 克。
55.常温下,将14.0克的Na2O和Na2O2的混合物放入水中,得到400 mL pH=14的溶液,则产生的气体标准状况下体积为 L。
56.在200mLAl2(SO4)3和MgSO4的混合液中,加入一定量的Na2O2充分反应,至沉淀质量不再减少时,测得沉淀质量为5.8克。此时生成标准状况下气体体积为5.6 L。
则原混合液中c (SO42-)= mol/L。
57.取17.88 g NaHCO3 和 Na2O2 的固体混合物,在密闭容器中加热到 250 ℃,经充分反应后排出气体,冷却后称得固体质量为15.92 g。请列式计算:
①求原混合物中Na2O2的质量
②若要将反应后的固体反应完,需要1mol/L盐酸的体积为多少毫升?
正确答案
m
解析
CO和H2的混合气体燃烧的方程式:2CO+O2

考查方向
本题考查利用化学方程式的计算
解题思路
利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应;2CO+O2
2H2+O2
易错点
差量法的应用,找准固体物质,分析差量
教师点评
本题考查利用化学方程式的计算,为近几年高考中的重要考查内容,难度中等
正确答案
1.12L
解析
设14.0g混合物中含有氧化钠xmol,含有过氧化钠ymol,则①62x+78y=14,最后得到的溶质为NaOH,得到400mL pH=14的溶液,氢氧化钠的物质的量为:0.4×1=0.4mol,根据钠原子守恒可得:②2x+2y=0.4,联合①②解得:x=0.1、y=0.1,所以0.1mol的过氧化钠生成0.05mol的氧气,标况下生成的氧气的体积为:V(O2)=22.4L/mol×0.05mol=1.12L
考查方向
本题考查混合物的计算
解题思路
氧化钠、过氧化钠与水反应后的溶质为氢氧化钠,根据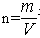
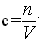
易错点
氧化钠与过氧化钠的化学性质
教师点评
本题考查混合物的计算,涉及pH的计算,题目难度中等
正确答案
2
解析
生成标准状况下气体体积为5.6L,其物质的量为0.25mol,所以过氧化钠的物质的量为0.5mol,所以氢氧化钠的物质的量为:0.5mol×2=1mol,沉淀质量为5.8克,即氢氧化镁的质量为5.8克,所以氢氧化镁的物质的量为0.1mol,生成氢氧化镁消耗氢氧根离子的物质的量为0.1×2=0.2mol,则铝离子转化为偏铝酸根离子消耗氢氧根的物质的量为0.8,所以铝离子的物质的量为0.2mol,所以溶液中硫酸根离子的物质的量为:0.3+0.1=0.4mol,则浓度为2mol/L
考查方向
本题考查溶液中的离子反应及其计算
解题思路
据生成的气体的体积可得到过氧化钠与水反应后生成的NaOH的物质的量,至沉淀质量不再减少时,沉淀为氢氧化镁,根据其质量可得到镁离子结合的氢氧根离子的物质的量,从而得到与铝离子反应的氢氧根离子的物质的量,就算出硫酸根离子的物质的量,得其浓度
易错点
熟知溶液中的各离子反应是求解的关键,熟知反应的量的关系
教师点评
本题考查溶液中的离子反应及其计算,是高考重点考查内容,题目难度中等
正确答案
7.8克 (3分) 200mL≤V≤320mL(3分)
解析
①设Na2O2 和NaHCO3的物质的量分别为x,y
2Na2O2+4NaHCO3=4Na2CO3+2H2O↑+O2↑
492 424
17.88 15.41
2Na2O2+2NaHCO3=2Na2CO3+2NaOH+O2↑
324 292
17.88 16.11
15.41<15.92<16.11 说明两个反应都发生
所以78x+84y=17.88 106y+(2x-y)×40=15.92
解之得:x=0.1mol、y=0.12mol
所以m(Na2O2)=7.8g,
②反应后固体为0.08mol的NaOH和0.12mol的Na2CO3,当反应后溶质为NaCl、NaHCO3时,则需盐酸体积为200mL;当反应后溶质只有NaCl时,则需盐酸体积为320mL
所以盐酸体积为200mL≤V≤320mL,
考查方向
本题考查混合物的计算
解题思路
①设Na2O2 和NaHCO3的物质的量分别为x,y
2Na2O2+4NaHCO3=4Na2CO3+2H2O↑+O2↑
492 424
17.88 15.41
2Na2O2+2NaHCO3=2Na2CO3+2NaOH+O2↑
324 292
17.88 16.11
15.41<15.92<16.11 说明两个反应都发生
所以78x+84y=17.88 106y+(2x-y)×40=15.92
解之得:x=0.1mol、y=0.12mol
所以m(Na2O2)=7.8g,
②反应后固体为0.08mol的NaOH和0.12mol的Na2CO3,当反应后溶质为NaCl、NaHCO3时,则需盐酸体积为200mL;当反应后溶质只有NaCl时,则需盐酸体积为320mL
易错点
物质的化学性质是分析题目的关键
教师点评
本题考查混合物的计算,题目难度中等,熟知物质的化学性质是解题的关键,注重培养学生的化学计算能力
20.向100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol/L的盐酸, 测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图 所示。下列说法正确的是
正确答案
解析
Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸.
首先,发生反应AlO2-+H++H2O═Al(OH)3↓,最左边曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05L×1mol/L=0.05mol.
第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,ab线表示CO32-,bc线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol.
第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,cd线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+).
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,de线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为0.15mol/1mol/L=0.15L=150mL
A.由上述分析可知,原混合溶液中的CO32-与AlO2-的物质的量之比为0.05mol:0.05mol=1:1,故A正确;
B.a点溶液中,溶质为Na2CO3,由质子守恒可知:c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),故B错误;
C.b点碳酸钠和碳酸氢钠的浓度相等,加入了75mL盐酸,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-),故C正确;
D.d→e的过程中铝离子的浓度逐渐增大,铝离子水解促进了水的电离,则该段水的电离程度逐渐增大,故D错误
考查方向
离子浓度
解题思路
Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸.
首先,发生反应AlO2-+H++H2O═Al(OH)3↓,最左边曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05L×1mol/L=0.05mol.
第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,ab线表示CO32-,bc线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol.
第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,cd线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+).
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,de线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为0.15mol/1mol/L=0.15L=150mL.据此结合选项解答
易错点
由图像得出先反应的离子为AlO2-
教师点评
本题考查了离子浓度大小比较,题目难度中等,明确发生反应的先后顺序为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义及应用方法,试题培养了学生的分析、理解能力及灵活应用能力
知识点
6. 实验:① 0.005 mol·L-1 FeCl3溶液和0.015 mol·L-1 KSCN溶液各1 mL混合得到红色溶液 a,均分溶液a置于b、c两支试管中; ② 向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;③ 再向上述b溶液中滴加3滴1 mol·L-1 NaOH溶液,溶液颜色变浅且出现浑浊; ④ 向c中逐渐滴加1mol·L-1 KSCN
下列分析不正确的是
正确答案
解析
A、根据反应Fe3++3SCN-⇌Fe(SCN)3,增大Fe3+浓度,平衡正向移动,故A正确;
B、上述b溶液中滴加NaOH溶液,三价铁与氢氧根离子反应生成氢氧化铁沉淀,反应为Fe3++3OH-═Fe(OH)3↓,故B正确;
C、实验③中使平衡逆向移动,生成氢氧化铁沉淀,红色变浅,实验④使平衡正向移动,后继续加溶液相当于稀释,红色变浅,原因不同,故C错误;
D、根据上述分析,实验②、③、④均可说明浓度改变对平衡移动的影响,故D正确
考查方向
化学平衡
解题思路
A、根据反应Fe3++3SCN-⇌Fe(SCN)3,增大Fe3+浓度,平衡正向移动;
B、上述b溶液中滴加NaOH溶液,三价铁与氢氧根离子反应生成氢氧化铁沉淀,反应为Fe3++3OH-═Fe(OH)3;
C、实验③中使平衡逆向移动,生成氢氧化铁沉淀,红色变浅,实验④使平衡正向移动,后继续加溶液相当于稀释,红色变浅,原因不同;
D、根据上述分析,实验②、③、④均可说明浓度改变对平衡移动的影响
易错点
实验 ④ 的溶液颜色变化原因
教师点评
本题考查了化学平衡移动基本原理,分析浓度对平衡移动的影响,属于基础知识,难度不大,要求学生能根据反应原理判断实验现象
知识点
14.有一种粉末它是由铁的氧化物中的一种或者两种组成,取3.04 g粉末加热,同时通入足量的CO使之完全反应,再用过量澄清石灰水把生成的气体充分吸收,产生沉淀5g。 则该粉末的组成是( )
正确答案
解析
澄清石灰水将生成的气体充分吸收,产生沉淀5g为碳酸钙的质量,物质的量为

令FeO和Fe3O4混的物质的量分别为xmol、ymol,则根据铁原子和氧原子守恒: 
故选D.
考查方向
解题思路
设铁的氧化物化学式为FexOy,发生反应FexOy+yCO=xFe+yCO2,可知氧化物中氧原子的物质的量等于二氧化碳的物质的量,澄清石灰水将生成的气体充分吸收,产生沉淀5g为碳酸钙的质量,根据
易错点
判断氧化物中氧原子的物质的量等于二氧化碳的物质的量是解题的关键
知识点
10.向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
正确答案
解析
Na2CO3、NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-减少,第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d线表示HCO3-减少,此阶段Al(OH)3不参与反应,
A.Na2CO3,NaAlO2的混合溶液中加入HCl溶液,先发生反应:AlO2-+H++H2O═Al(OH)3↓,故A正确;
B.第二阶段,AlO2-反应完毕,发生反应:CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,所以b和c曲线表示的离子反应是相同的,故B正确;
C.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO32-反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)0.05mol,m[Al(OH)3]=0.05mol×78g/mol=3.9g,故C正确;
D.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO32-+H+═HCO3-,可知CO32-与AlO2-的物质的量之比为1:1,但这两种物质都是强碱弱酸盐都能水解,水解程度不同导致无法判断溶液中CO32-与AlO2-的物质的量之比,故D错误;
故选D.
考查方向
解题思路
Na2CO3、NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-减少,第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d线表示HCO3-减少,此阶段Al(OH)3不参与反应,
A.Na2CO3,NaAlO2的混合溶液中加入HCl溶液,先发生反应:AlO2-+H++H2O═Al(OH)3↓
B.第二阶段,AlO2-反应完毕,发生反应:CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,所以b和c曲线表示的离子反应是相同的
C.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO32-反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)0.05mol,m[Al(OH)3]=0.05mol×78g/mol=3.9g
D.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO32-+H+═HCO3-,可知CO32-与AlO2-的物质的量之比为1:1,但这两种物质都是强碱弱酸盐都能水解,水解程度不同导致无法判断溶液中CO32-与AlO2-的物质的量之比
易错点
图中所给信息不能转化为有用的已知条件
知识点
扫码查看完整答案与解析



