- 化学综合计算
- 共266题
7.室温下,0.2 mol·L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是 ( )
正确答案
解析
BOH与HCl等体积、等浓度混合,二者完全反应,产物为BCl与H2O。溶液中存在的微粒可能有,H+ 、OH- 、Cl- 、B+ 、BOH、 H2O从图中我们可以看出X、Y、Z均不相等,所以,BOH一定为弱碱,在溶液中所含的离子中Cl- 的浓度最大,其次为B+,所以则X为H+,Y为BOH,Z为OH-,所以溶液一定显酸性,A错误。升高温度,有利于B+水解,c(X)、 c(Y)都增大,B选项正确。溶液中的B原子与Cl原子相等,利用原子守恒得出, C项正确。稀释溶液,水解程度增大,但是c(X)减小,D错误。
考查方向
解题思路
先由强酸与碱完全反应,再对碱是强碱与弱碱作假设,去伪存真。再运用三大守恒对选项分析。
易错点
对反应后存在的离子判断不清,电解质溶液中的三大守恒不能灵活运用。
知识点
3.右表为元素周期表的一部分,X、Y、Z、W、R为短周期元素,其中Z元素的原子最外层电子数是其内层电子数的3倍。下列说法正确的是()
正确答案
解析
X、Y、Z、W、R为短周期元素,其中Z元素的原子最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素,由元素在周期表中的位置可知,X为C元素,Y为N元素、W为S元素,R为Al、T为Ga。
A.电子层结构相同的离子,核电荷数越大离子半径越小,离子半径电子层越多离子半径越大,故离子半径:S2﹣>N3->O2﹣>Al3+,故A错误;
B.碳元素有石墨、金刚石、C60等多种同素异形体,氧元素可以形氧气、臭氧,存在同素异形体,故B错误;
C.Al2S3在溶液中发生水解反应生成氢氧化铝与硫化氢,不能用AlCl3溶液与Na2S溶液混合制取,故C错误;
D.Ga与Al相邻,其性质与Al相似,可能与既能与盐酸反应又能与NaOH溶液反应,故D正确。
故选D。
考查方向
解题思路
X、Y、Z、W、R为短周期元素,其中Z元素的原子最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素,由元素在周期表中的位置可知,X为C元素,Y为N元素、W为S元素,R为Al、T为Ga,据此解答。
易错点
本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握周期表的结构与元素化合物知识,难度中等。
知识点
13. 取少量0.1mol/
kJ·mol-1, 则Na2SO4(aq)+Ba(NO3)2(aq)=BaSO4(s)+2NaNO3(aq)∆H=( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.已知:
①H2O(g)===H2O(l);ΔH1=-Q1kJ/mol
②C2H5OH(g)===C2H5OH(l);ΔH2=-Q2kJ/mol
③C2H5OH(g)+3O2(g)―→2CO2(g)+3H2O(g);ΔH3=-Q3kJ/mol
若使23g液态酒精完全燃烧,最后恢复到室温,则放出的热量为( )(kJ)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为( );
(4)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式( );
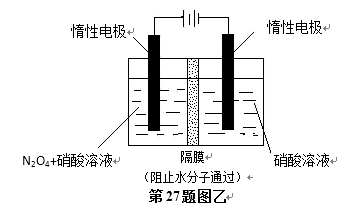
(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图乙所示,N2O5在电解池的 ( )(填“阳极”或“阴极”)区生成,其电极反应式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下列叙述与对应图式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.新的《环境空气质量标准》(GB3095-2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了 S02、NO2, CO、O3,PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1) 汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因______。

已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.现在科学家正在寻求将太阳能转化成化学能,其中办法之一就是利用太阳能将H2O分解成H2,再将化学能转化为其它能源。下面是有关的能量循环示意图,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. (一) (1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
请回答:
① 甲烷燃料电池的负极反应式是________。
② 当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4- 均可看作酸,则它们酸性由强到弱的顺序为__________________________(填编号);
(2)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+);(填“>”、“=”或“<”)
(3)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是( );
(4)如右下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是 ( )
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析