- 比色法
- 共1072题

步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液,10mL水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙、静置、过滤即得粗产品.
(1)a中制备溴苯反应的化学方程式______.
(2)b中的液溴不能快速加入是为了防止因反应放热而使______挥发(填化学式),影响产率.
(3)仪器c的作用是______,d的作用是______.
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是______.
正确答案
解:(1)在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应生成溴苯和溴化氢,反应的化学方程式为

故答案为:

(2)苯与液溴的反应为放热反应,若加入液溴速度过快,反应会放出较多的热量,由于苯和溴的沸点较低,导致苯和溴会挥发出来,影响了溴苯的产率,将b中的液溴慢慢加入到a中,防止反应放出的热使C6H6、Br2挥发而影响产率,
故答案为:C6H6、Br2;
(3)苯的沸点为80℃,溴的沸点为59℃,二者沸点较低,容易挥发出来,仪器c冷凝器的作用是冷凝回流C6H6、Br2,仪器d中发生的主要反应是吸收HBr气体,防污染防倒吸,
故答案为:冷凝回流;吸收HBr防污染防倒吸;
(4)利用沸点不同,苯的沸点小,被蒸馏出,溴苯留在母液中,所以采取蒸馏的方法分离溴苯与苯,故答案为:蒸馏.
解析
解:(1)在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应生成溴苯和溴化氢,反应的化学方程式为

故答案为:

(2)苯与液溴的反应为放热反应,若加入液溴速度过快,反应会放出较多的热量,由于苯和溴的沸点较低,导致苯和溴会挥发出来,影响了溴苯的产率,将b中的液溴慢慢加入到a中,防止反应放出的热使C6H6、Br2挥发而影响产率,
故答案为:C6H6、Br2;
(3)苯的沸点为80℃,溴的沸点为59℃,二者沸点较低,容易挥发出来,仪器c冷凝器的作用是冷凝回流C6H6、Br2,仪器d中发生的主要反应是吸收HBr气体,防污染防倒吸,
故答案为:冷凝回流;吸收HBr防污染防倒吸;
(4)利用沸点不同,苯的沸点小,被蒸馏出,溴苯留在母液中,所以采取蒸馏的方法分离溴苯与苯,故答案为:蒸馏.
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,已知苯胺微溶于冷水;纯乙酰苯胺是无色片状晶体,熔点114℃,不溶于冷水,可溶于热水;乙酸酐遇水缓慢反应生成乙酸;现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
实验步骤
①取5.0mL苯胺(密度1.04g/mL),倒入100mL锥形瓶中,加入20mL水,在旋摇下分批加入6.0mL乙酸酐(密度1.08g/mL),搅拌均匀.若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水.稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品.
(1)步骤①研碎块状产物的用意在于______;反应温度过高会导致苯胺挥发,下列可以控制反应温度,防止反应温度升高过快的操作有______;
A.反应快结束时的充分搅拌 B.旋摇下分批加入6.0mL乙酸酐
C.玻璃棒将块状物研碎 D.加20mL水
(2)步骤②洗涤粗产品时,选用的溶剂是______;
A.热水 B.冷水
C.1:3的乙醇溶液 D.滤液
(3)步骤③两次用到过滤,其中过滤Ⅰ选择______(过滤、趁热过滤或抽滤),过滤Ⅰ操作是为了除去______;配制热溶液时,加入过量溶剂的作用是______(选出正确选项);
A.防止后续过程中,溶剂损失可能产生的产物析出
B.防止后续过程中,温度降低可能产生的产物析出
C.除去活性炭未吸附完全的有色杂质
(4)步骤③中以下哪些操作不能提高产率______;
①配制成饱和溶液后,加入过量20%的溶剂;
②趁热过滤近沸溶液;
③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;
④加活性炭吸附;
⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体.
A.①④⑤B.①④C.④⑤D.②④⑤
(5)步骤③最后测得纯乙酰苯胺固体6.75g,已知苯胺、乙酸酐和乙酰苯胺的摩尔质量分别为93g/mol、102g/mol、135g/mol.该实验的产率为______(保留两位有效数字).
正确答案
解:(1)若有结块现象产生,反应物可能被产物包裹,反应不能充分,影响了产率,所以步骤①研碎块状产物的目的为:防止原料被产物包裹,使之充分反应,提高产率;
A.反应快结束时的充分搅拌,使反应更完全,无法降低反应速率,可能会导致反应速率加快,温度升高,故A错误;
B.旋摇下分批加入6.0mL乙酸酐,使反应物浓度较小,反应速率较慢,从而降低了反应温度,故B正确;
C.玻璃棒将块状物研碎,目的是防止原料被产物包裹,使之充分反应,不利于控制温度,故C错误;
D.加20mL水,可以使溶液稀释,降低反应速率,还可以使溶液质量增大,从而降低了温度,故D正确;
故答案为:防止原料被产物包裹,使之充分反应,提高产率;BD;
(2)苯胺微溶于冷水,而纯乙酰苯胺不溶于冷水,可溶于热水,且乙酸酐遇水缓慢反应生成乙酸,所以可用冷水洗涤粗产品乙酰苯胺,从而除去含有的杂质苯胺和乙酸酐,所以B正确,
故答案为:B;
(3)根据步骤③操作方法可知,过滤Ⅰ的目的是除去用于吸附有色物质的活性炭,由于乙酰苯胺的溶解度受温度影响较大,无论避免温度降低析出乙酰苯胺,所以需要趁热过滤;加入过量的水的,可以避免在操作过程中因溶剂的损失或温度的降低析出产物,影响产率,与活性炭的吸附性无关,所以AB正确,
故答案为:趁热过滤;除去活性炭;AB;
(4)①配制成饱和溶液后,加入过量20%的溶剂,可以防止后续过程中,溶剂损失、温度降低可能导致的产物析出,有利于提高产率;
②趁热过滤近沸溶液,乙酰苯胺的溶解度受温度影响较大,较高温度下可以减少在过滤过程中导致产物减少,有利于提高产率;
③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,避免烧杯和漏斗中有残留的产物,可以提高产;
④加活性炭吸附,需要吸附有色物质,无法提高产率;
⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体,导致乙酰苯胺的溶解度增大,损失的乙酰苯胺较多,降低了产率;
根据以上分析可知,可以通过产率的有:①②③;不能提高产率的为:④⑤,所以C正确,
故答案为:C;
(5)5.0mL苯胺(密度1.04g/mL)的物质的量为:
6.0mL乙酸酐(密度1.08g/mL)的物质的量为:
乙酸酐过量,理论上反应生成乙酰苯胺的物质的量为0.056mol,
则该实验乙酰苯胺的产率为:
故答案为:89%.
解析
解:(1)若有结块现象产生,反应物可能被产物包裹,反应不能充分,影响了产率,所以步骤①研碎块状产物的目的为:防止原料被产物包裹,使之充分反应,提高产率;
A.反应快结束时的充分搅拌,使反应更完全,无法降低反应速率,可能会导致反应速率加快,温度升高,故A错误;
B.旋摇下分批加入6.0mL乙酸酐,使反应物浓度较小,反应速率较慢,从而降低了反应温度,故B正确;
C.玻璃棒将块状物研碎,目的是防止原料被产物包裹,使之充分反应,不利于控制温度,故C错误;
D.加20mL水,可以使溶液稀释,降低反应速率,还可以使溶液质量增大,从而降低了温度,故D正确;
故答案为:防止原料被产物包裹,使之充分反应,提高产率;BD;
(2)苯胺微溶于冷水,而纯乙酰苯胺不溶于冷水,可溶于热水,且乙酸酐遇水缓慢反应生成乙酸,所以可用冷水洗涤粗产品乙酰苯胺,从而除去含有的杂质苯胺和乙酸酐,所以B正确,
故答案为:B;
(3)根据步骤③操作方法可知,过滤Ⅰ的目的是除去用于吸附有色物质的活性炭,由于乙酰苯胺的溶解度受温度影响较大,无论避免温度降低析出乙酰苯胺,所以需要趁热过滤;加入过量的水的,可以避免在操作过程中因溶剂的损失或温度的降低析出产物,影响产率,与活性炭的吸附性无关,所以AB正确,
故答案为:趁热过滤;除去活性炭;AB;
(4)①配制成饱和溶液后,加入过量20%的溶剂,可以防止后续过程中,溶剂损失、温度降低可能导致的产物析出,有利于提高产率;
②趁热过滤近沸溶液,乙酰苯胺的溶解度受温度影响较大,较高温度下可以减少在过滤过程中导致产物减少,有利于提高产率;
③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,避免烧杯和漏斗中有残留的产物,可以提高产;
④加活性炭吸附,需要吸附有色物质,无法提高产率;
⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体,导致乙酰苯胺的溶解度增大,损失的乙酰苯胺较多,降低了产率;
根据以上分析可知,可以通过产率的有:①②③;不能提高产率的为:④⑤,所以C正确,
故答案为:C;
(5)5.0mL苯胺(密度1.04g/mL)的物质的量为:
6.0mL乙酸酐(密度1.08g/mL)的物质的量为:
乙酸酐过量,理论上反应生成乙酰苯胺的物质的量为0.056mol,
则该实验乙酰苯胺的产率为:
故答案为:89%.
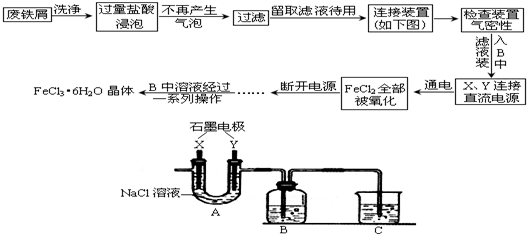
某化学兴趣小组利用废铁屑制取FeCl3•6H2O晶体.主要操作流程如下:
请回答下列问题:
(1)C烧杯中盛放的试剂的作用是______.
(2)A中的X极应该连接电源的______极,A中发生反应的离子方程式为______.
(3)试剂瓶B中的溶液经过一系列操作得到FeCl3•6H2O晶体,这一系列操作由下列操作组成(操作不重复),则依次进行的操作为______(填字母序号)A.加热浓缩 B.洗涤干燥 C.过滤 D.冷却结晶
(4)在整个实验过程中,盐酸必须保持过量,其主要原因是______,该装置有无缺陷,若有,请回答______,若无本空可不答.
正确答案
解:为了制备FeCl3•6H2O,因此必须在Y电极产生氯气,将B中的氯化亚铁氧化,所以X电极连接电源负极,A中发生的反应为2Cl-+2H2OCl2+H2+2OH-,B中亚铁离子被氧化为铁离子;在实验中,多余的氯气肯定会通过导管排出,而氯气有毒,所以必须进行尾气处理,故C中盛放NaOH溶液;
(1)根据以上分析,C烧杯中盛放的NaOH溶液是了吸收Cl2,防止污染环境,故答案为:吸收Cl2,防止污染环境;
(2)Y电极产生氯气,将B中的氯化亚铁氧化,所以X电极连接电源负极,A中发生的反应为2Cl-+2H2OCl2+H2+2OH-,故答案为:负;2Cl-+2H2O
(3)由剂瓶B中的FeCl3溶液经过加热浓缩、冷却结晶、过滤、洗涤干燥得到FeCl3•6H2O晶体,故答案为:ADCB;
(4)根据以上分析,X电极生成氢气,无任何处理,所以该装置的缺陷为缺少H2尾气处理装置,故答案为:缺少H2尾气处理装置.
解析
解:为了制备FeCl3•6H2O,因此必须在Y电极产生氯气,将B中的氯化亚铁氧化,所以X电极连接电源负极,A中发生的反应为2Cl-+2H2OCl2+H2+2OH-,B中亚铁离子被氧化为铁离子;在实验中,多余的氯气肯定会通过导管排出,而氯气有毒,所以必须进行尾气处理,故C中盛放NaOH溶液;
(1)根据以上分析,C烧杯中盛放的NaOH溶液是了吸收Cl2,防止污染环境,故答案为:吸收Cl2,防止污染环境;
(2)Y电极产生氯气,将B中的氯化亚铁氧化,所以X电极连接电源负极,A中发生的反应为2Cl-+2H2OCl2+H2+2OH-,故答案为:负;2Cl-+2H2O
(3)由剂瓶B中的FeCl3溶液经过加热浓缩、冷却结晶、过滤、洗涤干燥得到FeCl3•6H2O晶体,故答案为:ADCB;
(4)根据以上分析,X电极生成氢气,无任何处理,所以该装置的缺陷为缺少H2尾气处理装置,故答案为:缺少H2尾气处理装置.
工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4•2H2O),再高温煅烧草酸镍制取三氧化二镍.已知草酸的钙、镁、镍盐均难溶于水.根据下列工艺流程示意图回答问题.
(1)Ca的原子结构示意图为______.
(2)生产过程中多次进行过滤,玻璃棒在过滤操作中的一个作用是引流,下列实验操作中玻璃棒起引流作用的是______ (填选项字母).
a.测定Na2CO3溶液的pH
b.配制0.1mol/L的H2SO4溶液
c.加热NaCl溶液制备NaCl晶体
d.验证Ba(OH)2•8H2O与NH4Cl固体反应吸热
(3)加入H2O2发生的主要反应的离子方程式为______;加入Na2CO3溶液调 pH至4.0~4.5,其目的为______;加入NH4F后除掉的杂质是______.
(4)草酸镍(NiC2O4•2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得Ni2O2,同时获得混合气体.无水草酸镍受热分解的化学方程式为______.
(5)工业上还可在弱碱性条件下用ClO-把二价镍氧化为三价镍.ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为______.
正确答案
解:(1)Ca原子为20号元素,核内有20个质子,核外有4个电子层,

(2)a.测定Na2CO3溶液的pH,玻璃棒蘸取溶液滴在pH试纸上测定,故a不选;
b.配制O.1mol/L的H2SO4溶液,搅拌引流作用,故b选;
c.加热NaCl溶液制备NaCl晶体,玻璃棒搅拌避免局部受热固体飞溅,故c不选;
d.验证Ba(OH)2•8H2O与NH4Cl,玻璃棒搅拌避免局部受热固体飞溅,故d不选;
故答案为:b;
(3)加双氧水的目的是氧化生成Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,加入碳酸钠溶液的作用是调节pH,促进铁离子水解沉淀完全,再加入NH4F的目的是除去钙离子、镁离子,故最后加草酸时生成草酸镍沉淀;
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;促进铁离子水解沉淀完全;Ca2+、Mg2+;
(4)草酸镍(NiC2O4•2H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应(Ni由+2价升高到+3价,则C由+3价降低到+2价,题中要求生成混合气体,则另一气体为CO2)生成Ni2O3、CO、CO2,再利用化合价升降相等,Ni:升高2×(3-2),C:升高1×(4-3),C:降低:3×(3-2),配平方程式为:2NiC2O4
故答案为:2NiC2O4
(5)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确,得到离子方程式为:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;
故答案为:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O.
解析
解:(1)Ca原子为20号元素,核内有20个质子,核外有4个电子层,

(2)a.测定Na2CO3溶液的pH,玻璃棒蘸取溶液滴在pH试纸上测定,故a不选;
b.配制O.1mol/L的H2SO4溶液,搅拌引流作用,故b选;
c.加热NaCl溶液制备NaCl晶体,玻璃棒搅拌避免局部受热固体飞溅,故c不选;
d.验证Ba(OH)2•8H2O与NH4Cl,玻璃棒搅拌避免局部受热固体飞溅,故d不选;
故答案为:b;
(3)加双氧水的目的是氧化生成Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,加入碳酸钠溶液的作用是调节pH,促进铁离子水解沉淀完全,再加入NH4F的目的是除去钙离子、镁离子,故最后加草酸时生成草酸镍沉淀;
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;促进铁离子水解沉淀完全;Ca2+、Mg2+;
(4)草酸镍(NiC2O4•2H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应(Ni由+2价升高到+3价,则C由+3价降低到+2价,题中要求生成混合气体,则另一气体为CO2)生成Ni2O3、CO、CO2,再利用化合价升降相等,Ni:升高2×(3-2),C:升高1×(4-3),C:降低:3×(3-2),配平方程式为:2NiC2O4
故答案为:2NiC2O4
(5)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确,得到离子方程式为:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;
故答案为:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O.
实验室里用如图示出的装置制取溴化亚铁.其中,A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈管,e是两只耐高温的瓷夹,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中的物质开始反应,不断地将d中的液溴滴入100~120℃的D中,经过几小时的连续反应后在不锈钢管一端沉积有黄绿色鳞片状溴化亚铁80g.

(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为______.
(3)在A中盛有CaCO3,a中盛有6mol•L-1盐酸.为使A中产生的CO2在进入D之前既干燥又纯净,B、C处应设置和各仪器中应盛有何种试剂?______
______.
(4)实验时,D和E的橡胶塞为什么最好用铝箔包住?
______
(5)反应过程中要不断地通入CO2,其主要作用是:①______②______.
(6)E中进行的反应是:2Fe+3Br2=2FeBr3,2FeBr3=2FeBr2+Br2↑.此实验中溴化亚铁的产率为______.
(7)为防止污染空气,实验时应在F处连接盛有______的尾气吸收装置.
正确答案
解:(1)检查D装置的气密性方法为:关闭d的活塞,夹紧C、D间的胶管,将F的出口导管插入水中,用手捂住D,或微热,若F 的导管处有气泡冒出,松开手后水又回升到F的导管中,则证明D的气密性良好(即不漏气),
答:关闭d的活塞,夹紧C、D间的胶管,将F的出口导管插入水中,用手捂住D,或微热,若F 的导管处有气泡冒出,松开手后水又回升到F的导管中,则证明D的气密性良好(即不漏气)
(2)若导入的CO2不干燥,会在E中发生副反应,铁与水蒸气生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O
故答案为:3Fe+4H2O
(3)装置B用于除去二氧化碳中的氯化氢气体,可以用盛有NaHCO3饱和溶液的洗气瓶洗气;装置D作用是干燥二氧化碳,可以用盛有浓H2SO4的洗气瓶干燥,
故答案为:B处应设置盛有NaHCO3饱和溶液的洗气瓶,C处应设置盛有浓H2SO4的洗气瓶
(4)D和d中均盛有液溴,溴单质能够腐蚀橡胶塞,
答:因Br2会腐蚀橡胶塞;
(5)反应过程中要不断地通入CO2,其主要作用是为:反应前将容器中的空气赶净,避免空气中的氧气干扰实验;反应过程中可以将Br2蒸气带入反应器D中,使溴能够与铁粉充分反应,
故答案为:①将容器中的空气赶净,②将Br2蒸气带入反应器D中;
(6)根据关系式由Fe~FeBr2可算出,56g铁粉完全反应,理论上应生成溴化铁216g,
所以FeBr2的产率为:
故答案为:37.04%
(7)氢氧化钠溶液能够与溴单质反应,为防止污染空气,实验时应在F处连接盛有氢氧化钠溶液的尾气吸收装置,
故答案为:NaOH溶液.
解析
解:(1)检查D装置的气密性方法为:关闭d的活塞,夹紧C、D间的胶管,将F的出口导管插入水中,用手捂住D,或微热,若F 的导管处有气泡冒出,松开手后水又回升到F的导管中,则证明D的气密性良好(即不漏气),
答:关闭d的活塞,夹紧C、D间的胶管,将F的出口导管插入水中,用手捂住D,或微热,若F 的导管处有气泡冒出,松开手后水又回升到F的导管中,则证明D的气密性良好(即不漏气)
(2)若导入的CO2不干燥,会在E中发生副反应,铁与水蒸气生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O
故答案为:3Fe+4H2O
(3)装置B用于除去二氧化碳中的氯化氢气体,可以用盛有NaHCO3饱和溶液的洗气瓶洗气;装置D作用是干燥二氧化碳,可以用盛有浓H2SO4的洗气瓶干燥,
故答案为:B处应设置盛有NaHCO3饱和溶液的洗气瓶,C处应设置盛有浓H2SO4的洗气瓶
(4)D和d中均盛有液溴,溴单质能够腐蚀橡胶塞,
答:因Br2会腐蚀橡胶塞;
(5)反应过程中要不断地通入CO2,其主要作用是为:反应前将容器中的空气赶净,避免空气中的氧气干扰实验;反应过程中可以将Br2蒸气带入反应器D中,使溴能够与铁粉充分反应,
故答案为:①将容器中的空气赶净,②将Br2蒸气带入反应器D中;
(6)根据关系式由Fe~FeBr2可算出,56g铁粉完全反应,理论上应生成溴化铁216g,
所以FeBr2的产率为:
故答案为:37.04%
(7)氢氧化钠溶液能够与溴单质反应,为防止污染空气,实验时应在F处连接盛有氢氧化钠溶液的尾气吸收装置,
故答案为:NaOH溶液.
扫码查看完整答案与解析