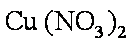- 硫酸铜晶体中结晶水含量的测定
- 共3题
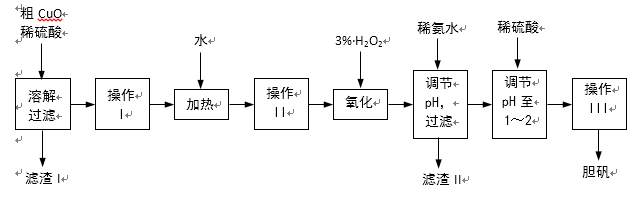
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:
经操作I得到粗胆矾,操作III得到精制胆矾。两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
已知: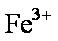
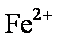
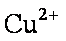
(1)溶解、过滤需要用到玻璃棒,它的作用是 。
(2)写出加入3% H2O2后发生反应的离子方程式 。(原溶液显酸性)。
(3)加稀氨水调节pH应调至范围 。下列物质可用来替代稀氨水的是 。
A,NaOH
B,Cu(OH)2
C,CuO
D,NaHCO3
(4)操作III析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、________________。
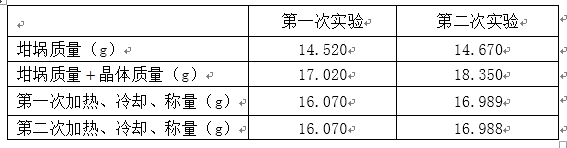
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
两次都无须再做第三次加热、冷却、称量,理由是 ,该生此次实验的相对误差为 %(保留1位小数),产生实验误差的原因可能是(填字母)。
A,加热前称量时坩埚未完全干燥
B,该胆矾中含有受热不分解的杂质
C,加热后坩埚放在干燥器中冷却
D,玻璃棒上沾有的固体未刮入坩埚
正确答案
(1)搅拌、引流
(2)2Fe2+ +H2O2 +2H+ →2Fe3+ +2H2O
(3)3.7~5.2 (1分) ; BC
(4) (NH4)2SO4 或NH4HSO4
(5)已达恒重 (1分);+4.2% ;AD
解析
略
知识点
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾。某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)过滤操作中用到的玻璃仪器有 。
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是 。
(3)滤渣a的主要成分是 。
(4)步骤③中X的取值范围是 。
(5)假设制得的CuSO4·5H2O中只含Na2SO4杂质,若用该样品进行“硫酸铜晶体结晶水含量的测定”实验,测得结晶水含量 (填“偏低”、“偏高”或“无影响”)。乙同学取1.280g该样品,加热至恒重称得质量变为0.830g,则此样品的纯度为 。(用小数表示,保留三位有效数字)
正确答案
(1) 烧杯、漏斗、玻璃棒
(2)Cu + H2O2+2H+ → Cu2++2 H2O
(3)Au
(4) 5.2≤X<5.4
(5) 偏低(2分),0.977
解析
略
知识点
测定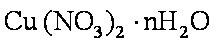
正确答案
解析
略
知识点
扫码查看完整答案与解析