- 用晶格能的大小衡量离子晶体中离子键的强弱
- 共11题
LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备。
18.FePO4难溶于水,制备方法如下:
Ⅰ.用稍过量的稀H2SO4溶解废铁屑,加热,搅拌,过滤;
Ⅱ.向滤液中加入一定量的H2O2;
Ⅲ.向含Fe3+的溶液加入Na2HPO4溶液,过滤后经进一步处理得FePO4。
①Ⅰ中反应进行完全的现象是 。
② 用离子方程式说明H2O2的作用是 。
③ 已知:H2PO 

产生FePO4的离子方
④ Na2HPO4溶液显碱性的原因是 。
19.制备LiFePO4:将FePO4与LiI混合,在惰性气氛中加热,制得LiFePO4 。
化合物LiI中碘离子的作用是 。
20.锂离子二次电池的负极材料为金属锂和石墨的复合材料(石墨作为金属锂的载体),电
池反应为: FePO4(s) +Li(s) 
①该电池不能用电解质水溶液,原因是 。
②充电时,b极的电极反应式是 。
正确答案
(1)① 不再产生气泡 (2 分)
② 2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O (2 分)
③ Fe3+ + 2HPO42- = FePO4↓+ H2PO4- (2 分)
④ 由于HPO42-可以电离:HPO42- 
H2PO4- + OH-,且水解程度大于电离程度,所以溶液溶解显碱性。(2 分)
解析
(1)用稍过量的稀H2SO4溶解废铁屑,滤液中主要溶质为FeCl2,向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,向含Fe3+的溶液加入Na2HPO4溶液,过滤后经进一步处理得FePO4.
①稀H2SO4溶解废铁屑时,有氢气产生;
②向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,过氧化氢被还原为水;
③向含Fe3+的溶液加入Na2HPO4溶液,Fe3+消耗PO43-,使平衡HPO42-⇌PO43-+H+右移,氢离子浓度增大,使平衡H2PO4-⇌HPO42-+H+左移,则溶液中H2PO4-浓度增大;
④Na2HPO4溶液显碱性的原因是水解程度大于电离程度;
考查方向
制备实验方案的设计
解题思路
(1)用稍过量的稀H2SO4溶解废铁屑,滤液中主要溶质为FeCl2,向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,向含Fe3+的溶液加入Na2HPO4溶液,过滤后经进一步处理得FePO4.
①稀H2SO4溶解废铁屑时,有氢气产生;
②向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,过氧化氢被还原为水;
③向含Fe3+的溶液加入Na2HPO4溶液,Fe3+消耗PO43-,使平衡HPO42-⇌PO43-+H+右移,氢离子浓度增大,使平衡H2PO4-⇌HPO42-+H+左移,则溶液中H2PO4-浓度增大;
④Na2HPO4溶液显碱性的原因是水解程度大于电离程度;
(2)铁元素的化合价从+3价降到+2价,得到电子,说明化合物LiI中碘离子失去电子作还原剂;
(3)①金属Li可与水发生反应(或2Li+2H2O=2LiOH+H2↑),故应为非水材料,
②根据锂离子电池的电池反应式为:FePO4(s)+Li(s)
易错点
本题容易出现化学方程式和离子方程式的书写错误。
正确答案
(2)作还原剂 (1 分)
解析
(2)铁元素的化合价从+3价降到+2价,得到电子,说明化合物LiI中碘离子失去电子作还原剂;
考查方向
制备实验方案的设计
解题思路
(1)用稍过量的稀H2SO4溶解废铁屑,滤液中主要溶质为FeCl2,向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,向含Fe3+的溶液加入Na2HPO4溶液,过滤后经进一步处理得FePO4.
①稀H2SO4溶解废铁屑时,有氢气产生;
②向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,过氧化氢被还原为水;
③向含Fe3+的溶液加入Na2HPO4溶液,Fe3+消耗PO43-,使平衡HPO42-⇌PO43-+H+右移,氢离子浓度增大,使平衡H2PO4-⇌HPO42-+H+左移,则溶液中H2PO4-浓度增大;
④Na2HPO4溶液显碱性的原因是水解程度大于电离程度;
(2)铁元素的化合价从+3价降到+2价,得到电子,说明化合物LiI中碘离子失去电子作还原剂;
(3)①金属Li可与水发生反应(或2Li+2H2O=2LiOH+H2↑),故应为非水材料,
②根据锂离子电池的电池反应式为:FePO4(s)+Li(s)
易错点
本题容易出现化学方程式和离子方程式的书写错误。
正确答案
(3)① 金属Li可与水发生反应(或2Li + 2H2O =2LiOH + H2↑)(1 分)
② LiFePO4 - e- = Li+ + FePO4 
解析
(3)①金属Li可与水发生反应(或2Li+2H2O=2LiOH+H2↑),故应为非水材料,
②根据锂离子电池的电池反应式为:FePO4(s)+Li(s)
考查方向
制备实验方案的设计
解题思路
(1)用稍过量的稀H2SO4溶解废铁屑,滤液中主要溶质为FeCl2,向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,向含Fe3+的溶液加入Na2HPO4溶液,过滤后经进一步处理得FePO4.
①稀H2SO4溶解废铁屑时,有氢气产生;
②向滤液中加入过氧化氢将亚铁离子氧化成Fe3+,过氧化氢被还原为水;
③向含Fe3+的溶液加入Na2HPO4溶液,Fe3+消耗PO43-,使平衡HPO42-⇌PO43-+H+右移,氢离子浓度增大,使平衡H2PO4-⇌HPO42-+H+左移,则溶液中H2PO4-浓度增大;
④Na2HPO4溶液显碱性的原因是水解程度大于电离程度;
(2)铁元素的化合价从+3价降到+2价,得到电子,说明化合物LiI中碘离子失去电子作还原剂;
(3)①金属Li可与水发生反应(或2Li+2H2O=2LiOH+H2↑),故应为非水材料,
②根据锂离子电池的电池反应式为:FePO4(s)+Li(s)
易错点
本题容易出现化学方程式和离子方程式的书写错误。
15.由库仑定律可知,真空中两个静止的点电荷,带电量分别为q1和q2,其间距离为r时,它们之间相互作用力的大小为
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝
③加入数滴氯水时,溶液无色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在溶液中是否存在的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.铜有多种化合物,氧化亚铜(Cu2O)、氯化亚铜(CuCl)、氯化铜(CuCl2)、CuSO4等。
完成下列计算:
(1)波尔多液是由硫酸铜、生石灰和水配制成的杀菌剂,不同情况下需要配制不同的比例。现配制按质量比CuSO4:CaO:H2O =1:2:200的波尔多液50Kg。
需要用CuSO4·5H2O__________g ,CaO__________mol
(2)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,精辉铜矿中含23%杂质,日均产含Cu量97.5%的粗铜42t。
已知:总反应式 Cu2S+O2
日均需精辉铜矿。__________t
日均产SO2标准状况下体积。__________L
(3)印刷线路板的铜能被FeCl3的溶液腐蚀,将印刷线路板浸入200mL FeCl3溶液中,有11.2g Cu被腐蚀掉。取出印刷线路板,向溶液中加入11.2g铁粉,充分反应溶液中还有4.8g不溶物。计算原FeCl3溶液的物质的量浓度。
(4)制备铜的某化合物晶体。取5.12g Cu、14.5mol/L HNO3 15 mL、6.0 mol/L HC1 50mL,混合后Cu完全反应,反应后溶液有中水54.32g,再经水浴保温蒸发掉42g水,冷却至20℃并过滤,得到8.12g晶体。通过计算推断此晶体的化学式。
已知:20℃溶解度 CuC12·2H2O 73g /100g H2O
Cu(NO3)2·3H2O 125g /100g H2O
正确答案
(1)385 ; 8.8
(2)66.5 ; 7.17×106
(3)
剩余不溶物Cu 共溶解Cu: 11.2-4.8=5.6g 6.4 /64=0.1mol
Fe: 11.2g 11.2 /56=0.2mol
C(FeCl3)=0.6mol/0. 2L=3.0mol/L
(4)混合后反应Cu+NO3-+H+−−Cu2++H2O+N O x↑
剩余硝酸根量少且Cu(NO3)2·3H2O溶解度大,析出的是CuC12晶体
设晶体化学式为CuC12·xH2O
无水CuC12 20℃溶解度 为
生成CuC12 5.12•135/64= 10.8g,剩余水54.32—42=12.32g
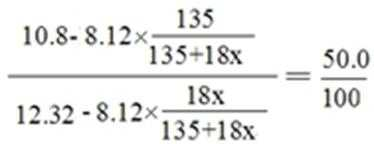
解析
解析已在路上飞奔,马上就到!
知识点
22.有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒精灯加热至恒重测得的数据如下:
经分析得到的15.600g固体是纯净物。则下列叙述正确的是( )
正确答案
解析
每小题有一个或两个正确选项,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
知识点
3.下列有关物质的性质或应用说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.将BaO2放入密闭真空容器中,反应2BaO2(s)═2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.某溶液中含有S2-.HCO.CO.CH3COO-4种阴离子。若向其中加入足量Na2O2后,溶液中离子数目基本保持不变的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:
下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. 过氧化镁MgO2易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。
(1)实验前需进行的操作是:( ),稀盐酸中加入少量FeCl3溶液的作用是:( ) 。
(2)用恒压分液漏斗的优点有:①( );②( )。
实验结束时,待恢复至室温,先( ),再平视刻度线读数。
实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过
滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
(3)推算该样品中过氧化镁的质量分数( )(用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1000 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.50 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
(4)该实验在滴定前需加入少量( )作指示剂;判断到达滴定终点的现象是( );
(5)推算该样品中过氧化镁的质量分数为( )。
正确答案
(1)检查装置的气密性 , 用作催化剂(或催化H2O2的分解)
(2)① 消除滴入溶液的体积对所测气体体积的影响;
②使分液漏斗中的溶液顺利滴下。
先将右侧刻度管缓缓向下移动直到两侧液面相平
(3) 7(a -b)/2a
(4)淀粉溶液; 蓝色变无色
(5)0.798
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析




