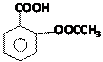- 有机物实验式和分子式的确定
- 共12题
13.【化学—选修5:有机化学基础】
芳香烃X,相对分子质量为92。以X为初始原料合成E,路线如下(部分产物和反应条件已略去)。
回答下列问题:
(1)有机物X的结构简式为________________________________________。
(2)A→B的反应条件为________________________________________。
(3)C→D转化中①的化学方程式为_____
(4)下列关于B的说法正确的是__________。
a.核磁共振氢谱
b.能发生消去反应和还原反应
c.能与钠反应放出氢气
d.能和NaOH溶液反应
(5)E有多种同分异构体,同时符合下列条件的同分异构体共有__________种。
①遇NaHCO3溶液有气体放出
②芳香族化合物
其中不含甲基的有机物的结构简式为____________________。
(6)有机物X可通过三步合成W,W是高分子化合物
已知:I.苯环上的甲基可以被酸性KMnO4氧化成羧基
II.苯环侧链的硝基可被Fe/HCl还原为氨基,苯环侧链的氨基易被氧化
①F的结构简式为____________________,试剂a为____________________。
②在一定条件下W聚合成高分子化合物的化学方程式为____________________。
正确答案
(1)
(2)NaOH水溶液 加热
(3)C6H5-CHO + 2Ag(NH3)2OH
(4)ac
(5)14种
(6) 
解析
根据芳香烃X相对分子质量为92可知,令其分子组成为CxHy,分子中最大碳原子数为92/12=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,其结构简式为




E为
(1)根据分析可知X的结构简式为
(2)A→B的反应为卤代烃水解,所以条件为NaOH水溶液、加热;
(3)C→D转化中①的化学反应为

(4)B为
a.苯环上有三个峰氢谱,-CH2OH上有2个峰,所以共有5个峰,正确;
b.与-CH2OH相连的碳原子上没有H原子,所以不能发生消去反应和还原反应,错误;
c.含有-OH,所以能与钠反应放出氢气,正确;
d.含有的-CH2OH没有酸性,所以不能和NaOH溶液反应错误。
(5)E为









考查方向
解题思路
根据芳香烃X相对分子质量为92可知,令其分子组成为CxHy,分子中最大碳原子数为92/12=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,其结构简式为




(1)有机物X的结构简式为
(2)A→B的反应为卤代烃水解,所以条件为NaOH水溶液、加热;
(3)C→D转化中①的化学反应为
(4)B为
a.苯环上有三个峰氢谱,-CH2OH上有2个峰
b.与-CH2OH相连的碳原子上没有H原子,所以不能发生消去反应和还原反应
c.含有-OH,所以能与钠反应放出氢气
d.含有的-CH2OH没有酸性,所以不能和NaOH溶液反应
(5)E为
(6)





易错点
不善于把握反应条件及有机物的结构变化、不注意题给条件信息、不能准确判断先氧化还是先还原、不能根据官能团变化来推断各物质,合成流程中不注意易被氧化官能团导致合成方案流程错误。
知识点
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
① CH4(g)+ H2O(g)= CO(g)+3H2(g) ∆H =+206.2kJ·mol-1
② CH4(g)+ CO2(g)= 2CO(g)+2H2(g) ∆H =+247.4kJ·mol-1
③ 2H2S(g)=2H2(g)+S2(g) ∆H =+169.8kJ·mol-1
23.以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
24.在密闭容器中充入一定量的H2S,发生反应③。如图所示为H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
①图中压强(p1、p2、p3)的大小顺序为 ,理由是 。
②该反应平衡常数的大小关系为K(T1) (填“>”、“<”或“=”)K(T2),理由是 。
③上图中M点的平衡常数Kp= MPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有 。
25.氢气燃料电池能大幅度提高能量的转化率。甲烷--空气碱性(KOH为电解质)燃料电池的负极反应式为 。相同条件下,甲烷燃料电池与氢气燃料电池的能量密度之比为 (单位质量的输出电能叫能量密度,能量密度之比等于单位质量的可燃物转移电子数之比)。
正确答案
CH4(g)+ 2H2O(g)=CO2(g)+4H2(g) ∆H =+165.0kJ·mol-1
解析
① CH4(g)+ H2O(g)= CO(g)+3H2(g) ∆H =+206.2kJ·mol-1
② CH4(g)+ CO2(g)= 2CO(g)+2H2(g) ∆H =+247.4kJ·mol-1
③ 2H2S(g)=2H2(g)+S2(g) ∆H =+169.8kJ·mol-1
CH4(g)与H2O(g)反应生成CO2(g)和H2(g),由盖斯定律,①×2-②得CH4(g)+ 2H2O(g)=CO2(g)+4H2(g) ∆H =+165.0kJ·mol-1;
考查方向
解题思路
由盖斯定律,①×2-②得CH4(g)+ 2H2O(g)=CO2(g)+4H2(g) ∆H =+165.0kJ·mol-1;
易错点
本题考查盖斯定律、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,难度不大,注意对高考热点的训练。
正确答案
①P1<P2<P3 该可逆反应的正反应是气体分子数增大的反应,相同温度下,增大压强,H2S的转化率减小
②< 该可逆反应的正反应是吸热反应,升高温度,平衡常数增大
③1
④及时分离出产物
解析
H2S气体分解生成H2和S2(g),该可逆反应的正反应是气体分子数增大的反应,在密闭容器中充入一定量的H2S,相同温度下,增大压强,H2S平衡转化率逆向进行;该反应是吸热反应,相同压强下,升高温度,H2S平衡转化率正向进行;
①相同温度下,增大压强,H2S平衡转化率逆向进行,压强的大小顺序为(p1<p2<p3),理由是该可逆反应的正反应是气体分子数增大的反应,相同温度下,增大压强,H2S的转化率减小;
②该反应是吸热反应,温度升高,平衡正向移动,因此平衡常数的大小关系为K(T1)<K(T2);
③M点: 2H2S(g)=2H2(g)+S2(g)
反应后分压(5MPa) 2/5 2/5 1/5
平衡常数
④如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有及时分离出产物;
考查方向
解题思路
H2S气体分解生成H2和S2(g),该可逆反应的正反应是气体分子数增大的反应,在密闭容器中充入一定量的H2S,相同温度下,增大压强,H2S平衡转化率逆向进行;该反应是吸热反应,相同压强下,升高温度,H2S平衡转化率正向进行;进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有及时分离出产物;
易错点
本题考查盖斯定律、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,难度不大,注意对高考热点的训练。
正确答案
CH4-8e一+10OH-=CO32-+7H2O 1:2
解析
甲烷--空气碱性(KOH为电解质)燃料电池的负极甲烷失去电子,在碱性条件下生成碳酸根离子,反应式为CH4-8e一+10OH-=CO32-+7H2O,相同条件下,16gCH4失去8mole一,16g失去16mole一,甲烷燃料电池与氢气燃料电池的能量密度之比为1:2。
考查方向
解题思路
甲烷--空气碱性(KOH为电解质)燃料电池的负极甲烷失去电子,在碱性条件下生成碳酸根离子,反应式为CH4-8e一+10OH-=CO32-+7H2O,相同条件下,16gCH4失去8mole一,16g失去16mole一,甲烷燃料电池与氢气燃料电池的能量密度之比为1:2。
易错点
本题考查盖斯定律、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,难度不大,注意对高考热点的训练。
11.阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药。下列有关说法正确的是
正确答案
解析
A. 乙酰水杨酸的间位和对位2种,另外羧基不变,酰基(连甲基)的构造有两种,每种有3个位置,所以共8种。但与乙酰水杨酸具有相同官能团的芳香族同分异构体没有8种(不考虑立体异构)
C.乙酰水杨酸中含-COO-、-COOH,苯环,名称分别为脂基、羧基,则乙酰水杨酸能发生取代、加成、氧化、还原反应。(-COOH,可发生酯化反应;含有苯环,可与氢气发生加成反应,也为还原反应,能燃烧,也为氧化反应)
B.阿司匹林中与苯环、羰基直接相连的原子可能共平面,其中苯环上的原子一定在同一个平面上,至少有12个。
D.乙酰水杨酸含-COO-脂基不易溶于水。
考查方向
本题主要考查了有机物分子中的官能团及其结构
解题思路
先确定乙酰水杨酸的位置异构数量;再确定羧基不变,酰基(连甲基)的构造数量,总数量=位置异构数量*酰基(连甲基)的构造数量。苯环,碳氧双键均为平面结构,苯环与碳氧双键可在一个平面结构内,但是甲基是四面体结构,乙酰水杨酸的部分原子在同一平面上。乙酰水杨酸中含-COO-、-COOH,苯环;-COO-脂基属于蹭水基团。
易错点
有机物的官能团与性质、结构与性质的关系。
知识点
(1)下面是以环戊烷为原料制备环戊二烯的合成路线:
X的名称为________,Y的结构简式为 ________,反应②的反应试剂和反应条件为_____________。
(2)金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
环戊二烯分子的分子式为__________;二聚环戊二烯的同分异构体中,属于芳香烃且苯环上的一氯代物有3种的同分异构体的结构简式为 ________ 。金刚烷的一氯代物有________种;金刚烷与四氢二聚环戊二烯的关系是 。(填字母)
A、互为同系物 b、互为同分异构体 c、均为烷烃 d、均为环烃
(3)写出环戊二烯在一定条件下生成高聚物的结构简式:________________。.
(4)烯烃也能发生如下反应:

正确答案
(1)环戊烯。 
(2)C5H6; 
(3)
(4)OHC-CHO + OHC-CH2-CHO。
解析
略
知识点
测定有机物中碳和氢等元素的含量,最常用的方法是燃烧分析法。即把已知量的样品置于氧气流中,用氧化铜作催化剂,在760℃左右,样品全部被氧化为二氧化碳和水。实验装置如下图所示:
(1)实验时,装置a、b中通常装入的物质分别是 、 。
(2)开始加热之前,要通一段时间的氧气,目的是 ;停止加热后,也要通一段时间的氧气,目的是 。
(3)某次实验中,取用样品烃的含氧衍生物A的质量为2.3g,经测定a装置增重2.7g,b装置增重4.4g。请推算出A物质的实验式: (要求写出计算过程)
(4)经进一步测定得知A的相对分子质量为46,则A的分子式为 。
(5)实验发现A物质遇金属钠可以放出氢气,则A物质中具有的官能团为 。同样取2.3g的A,与足量的钠反应,用如右图所示装置量取放出的氢气。量取气体时操作水准管的注意事项为 。将量取的气体换算成标准状况体积为cmL,则一个A分子中有 个氢原子被置换了(用含c的表达式表示)。
正确答案
答案:
(1)浓硫酸 碱石灰 (各1分)
(2)排出装置中的二氧化碳和水蒸气等 将燃烧生成的二氧化碳和水蒸气彻底排出 (各2分)
(3)C2H6O (过程略)(2分。不带推算过程扣1分)
(4)C2H6O (2分)
(5)羟基(1分) 使其中水的液面与量气管中水的液面相平(2分)

解析
略
知识点
扫码查看完整答案与解析