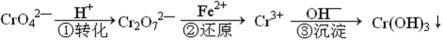- 氧化还原反应的计算
- 共67题
火法炼铜首先要焙烧黄铜矿,在高温下发生反应:2CuFeS2+O2→Cu2S+2FeS+SO2。下列说法正确的是
正确答案
解析
略
知识点
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为

正确答案
解析
略
知识点
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+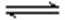
(1) 若平衡体系的pH=2,则溶液显 ___________ 色.
(2) 能说明第①步反应达平衡状态的是 ____________ 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) =v (CrO42—)
c.溶液的颜色不变 d. 溶液的pH值不变
(3) 第②步中,还原0.01mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(4) 许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+ + CrO2—(亮绿色) + H2O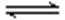
下列有关说法中正确的是
a、加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2—)
b、在一定条件下存在:Cr(OH)3 + OH— → CrO2— + 2H2O ;Cr(OH)3 + 3H+ → Cr3+ + 3H2O
c、Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中的存在叁个平衡
正确答案
(1)橙
(2)cd
(3)0.06
(4)ab
解析
略
知识点
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol/L的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g,下列说法不正确的是
正确答案
解析
略
知识点
铁是人类利用最为广泛的金属之一,工业炼铁一般用一氧化碳作还原剂。
(1)已知Fe2O3在高炉中有下列反应:Fe2O3+CO
a.7:3 b.21 8 c.14 5 d.7:2
(2)若m(Fe):m(O)=3:1,则Fe2O3与FeO的物质的量之比为_________,Fe2O3被CO还原的物质的量分数为___________ 。
(3)3.04 g Fe2O3和FeO的混合固体粉末在加热条件下用足量CO使金属氧化物完全还原,生成的CO2气体通入含0.04 mol Ca(OH)2的澄清石灰水后,产生3.00 g白色沉淀。计算固体粉末中Fe2O3的质量。(保留1位小数)
(4)常温下,称取不同铁锈样品溶入足量盐酸,向溶液中加入足量NaOH溶液生成沉淀,然后过滤、洗涤、灼烧,得到Fe2O3固体,实验过程中产品无损失。
实验数据记录如下:
上述实验①②③④所用铁锈均不含杂质,且实验数据可靠。通过计算,分析和比较上表4组数据,给出结论。
正确答案
(1)a、d
(2) 1:4 66.7%
(3)1.60 g
(4)①④是Fe2O3·3 H2O;②③是Fe2O3·2 H2O
解析
略
知识点
扫码查看完整答案与解析