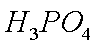- 电离方程式的书写
- 共11题
常温时向

正确答案
解析
略
知识点
8.
I草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)草酸的电离方程式: 。
(2)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
(3) 常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程)。
Ⅱ甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来
合成甲醇:CO(g)+2H2(g)
(4)下列各项中,不能说明该反应已达到平衡的是 。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
(5)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
请分别画出在T1 、T2温度下,H2的浓度随时间变化的曲线
(6)已知甲醇燃料电池的工作原理如图所示。
该电池负极的电极反应式为: ,
正确答案
略
解析
略
知识点
硝酸铜在工业上常用作催化剂、氧化剂、荧光粉激活剂及光敏电阻材料等。工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
(1) 在步骤α中,可通入空气,其目的是
(2)在保温去铁的过程中,为使Fe3+ 沉淀完全,可以向溶液中加入 ,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
某同学提出用加水的方法直接调节溶液的pH,你觉得合理吗?简单说明理由。
(3)进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
(4)该粗铜可用电解原理精炼,电精炼时阳极的电极反应式是
(5)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3
正确答案
见解析。
解析
(1)提高原料的利用率,减少污染物的排放
(2) CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3 3.2~4.7 加水会将溶液稀释,在后期将滤液蒸发浓缩时会消耗更多能源,不利于生产
(3)由于Cu2+发生水解:Cu2++2H2O
(4)Cu - 2e-=Cu2+
(5)N2O4
知识点
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
正确答案
解析
略
知识点
工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式________,属于弱酸的电离方程式________。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是________(选填编号)。
a. 气态氢化物的稳定性
b. 最高价氧化物对应水化物的酸性
c. 单质与氢气反应的难易
d. 单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为________。
(4) Na2CO3俗称纯碱,属于________晶体。工业上制取纯碱的原料是________。
正确答案
(1)

(2)ac
(3)Al(OH)3+OH-=AlO2- +2H2O
(4)离子晶体;氯化钠;二氧化碳;氨
解析
(1)HF、H2O属于极性分子,CO2属于非极性分子;HF属于弱酸,Al(OH)3属于两性氢氧化物。
(2)O、F两种元素在周期表中位置相邻,由于二者均无最高价氧化物对应的水化物,且二者属于非金属,单质不与酸反应,故比较非金属性强弱的依据为a、c。
(3)Na与Al处于同一周期,由于Al(OH)3属于两性氢氧化物,因而它能与强碱氢氧化钠反应。
(4)碳酸钠属于离子晶体,工业常利用侯氏制碱法制备:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ②2NaHCO3(加热)=Na2CO3+H2O+CO2↑故常用原料为NaCl、NH3、CO2。
知识点
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 ·
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为_ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为_ (填化学式)。
③NaH2PO2为_ (填“正盐”或“酸式盐”)}其溶液显 (填“弱酸性”.“中性”或“弱碱性”)。
(3)H3PO2的工业制法是,将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式
(4)也可用电渗析法制备,“四室电渗析法”工作原理如图所示〔阳膜和阴膜分别只允许阳离子,阴离子通过):
①写出阳极的电极反应式 。
②分析产品室可得到H3PO2原因_ ·
③早期采用“三室电渗析法”制备H3PO2:
将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有_ 杂质.该杂质产生的原因是
正确答案
(1)H3PO2
(2) ①+1
②
③正盐 弱碱性
(3)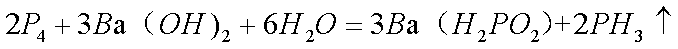
(4)①
②阳极室的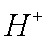
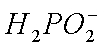

③
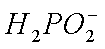
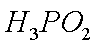
解析
略
知识点
氮元素的化合物种类繁多,性质也各不相同。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
则NO2氧化SO2的热化学方程式为________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g)
则平衡时氨气的转化率为________。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0.2mol电子时,生成气体在标准状况下的体积为________。联氨溶于水可以发生与氨水类似的电离,试写出联氨在水溶液中的电离方程式:________(写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-5 mol/L,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=________。
正确答案
(1)NO2(g)+SO2(g)
(2)40%
(3) 1.12L;N2H4+H2O
(4) Kb(NH3·H2O)=1×10-5mol/L
解析
略。
知识点
7.下列化学用语表示正确的
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.A、D、E、X、Y是原子序数依次增大的短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用。
(1)Y的离子结构示意图为( )。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有( )。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱,写出其一级电离方程式:( ) 。
②甲在碱性溶液中能够将CuO还原为Cu2O,已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:( )。
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 kJ热量,此反应的热化学方程式为( ) 。
(5)将0.050 mol YX2(g)和0.030 mol X2(g)放入容积为1 L的密闭容器中,反应:
X2(g) +2YX 2(g)
①若其他条件不变,增大体系的压强,平衡常数K( )(填“增大”、“减小”或“不变”)。
②平衡时测得c(X2)=0.010 mol·Lˉ1。该条件下反应的平衡常数K= ( ),YX2的平衡转化率为 ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列说法或表达正确的是( )
①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②向100 mL0.1 mol/L 的溴化亚铁溶液中通入0.05 mol的氯气时发生反应的离子方程式:
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
③斜长石KAlSi3O8的氧化物形式可表示为:K2O•Al2O3•3SiO2
④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:
IO3-+5I-+3H2O=I2+6OH-
⑤碳酸氢根离子的电离方程式可表示为:
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
⑦500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放
热19.3kJ,其热化学方程式为:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析