- 质子数、中子数、核外电子数及其相互联系
- 共12题
10.下列制定微粒的数目相等的是
正确答案
知识点
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
正确答案
知识点
10.草酸亚铁为黄色固体,作为一种化工原料, 可广泛用于涂料、染料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。合成草酸亚铁的流程如下:
(1)配制(NH4)2Fe(SO4)2溶液时,需加入少量稀硫酸,目的是 。
(3)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行加热分解,结果如下图(TG%表示残留固体质量占原样品总质量的百分数)。
①则A→B发生反应的化学方程式为: 。
②已知B→C过程中有等物质的量的两种气态氧化物生成,写出B→C的化学方程式 ;
(4)某草酸亚铁样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g样品,溶于少量2mol/L硫酸中并用100mL容量瓶定容。
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V1 mL。
Ⅲ.向上述溶液中加入足量Zn粉,使溶液中的Fe3+恰好全部还原为Fe2+,
Ⅳ.过滤,洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液
Ⅴ.用cmol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液的体积V2 mL。
已知:
2MnO4-+5H2C2O4+6H+= 2Mn2+ +10CO2+8H2O
MnO4-+8H++5Fe2+= 5Fe3+ + Mn2++4H2O
回答下列问题:
①若省略步骤Ⅳ,则测定的草酸根离子含量 (填“偏大”、“偏小”或“不变”)
②m g样品中草酸根离子的物质的量为 (用c,V1,V2的式子表示,不必化简)
正确答案
(1)抑制Fe2+和NH4+离子水解
解析
(1)由于Fe2+和NH4+离子容易发生水解而使溶液显酸性,所以加入稀硫酸可防止水解,故答案为:抑制Fe2+和NH4+离子水解;
考查方向
考查草酸亚铁的制备、除杂、净化等基本实验操作基础知识,以及考查根据草
酸亚铁受热分解变化过程中质量变化来确定反应过程,进一步考查了学生读图、识表等提取
信息以及加工信息的综合能力。
解题思路
(1)由于Fe2+和NH4+离子容易发生水解而使溶液显酸性,所以加入稀硫酸可防止水解。
易错点
不能准确提取题给信息,特别是草酸亚铁加热分解图中有关数据信息不能转化为解题信息致错。
正确答案
解析
①由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为36/180=×100%=20%,故A→B发生反应是FeC2O4.2H2O加热失去结晶水;反应的方程式为:FeC2O4·2H2O

②由图像可知在C处剩余固体的质量不再发生变化,所以最终的固体是FeO。FeC2O4在真空中分解的方程式为FeC2O4

(4)若省略步骤Ⅳ,则所得滤液中测定的草酸根离子含量Fe2+含量偏小,导致草酸根离子含量偏大;根据与草酸根离子反应的MnO4-量进行计算:与草酸根离子反应的MnO4-的物质的量为(cV1-cV2)×10-3mol,由于2MnO4-→5C2O42-,所以消耗的草酸根离子的物质的量为
(cV1- cV2)×10-3×(2/5)mol,同时由于从100mL溶液中取了20mL,故原溶液中草酸根离子的物质的量为(cV1-cV2)×10-3×5/2×5mol,故答案为:偏大;(cV1- cV2)×10-3×5/2×5mol。
考查方向
考查草酸亚铁的制备、除杂、净化等基本实验操作基础知识,以及考查根据草
酸亚铁受热分解变化过程中质量变化来确定反应过程,进一步考查了学生读图、识表等提取
信息以及加工信息的综合能力。
解题思路
①由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为36/180=×100%=20%,故A→B发生反应是FeC2O4.2H2O加热失去结晶水;
②由图像可知在C处剩余固体的质量不再发生变化,所以最终的固体是FeO。FeC2O4在真空中分解的方程式为FeC2O4==FeO+CO↑+CO2↑;
易错点
不能准确提取题给信息,特别是草酸亚铁加热分解图中有关数据信息不能转化为解题信息致错。
正确答案
(4)①偏大②(cV1- cV2)×10-3×5/2×5mol
解析
(4)若省略步骤Ⅳ,则所得滤液中测定的草酸根离子含量Fe2+含量偏小,导致草酸根离子含量偏大;根据与草酸根离子反应的MnO4-量进行计算:与草酸根离子反应的MnO4-的物质的量为(cV1-cV2)×10-3mol,由于2MnO4-→5C2O42-,所以消耗的草酸根离子的物质的量为
(cV1- cV2)×10-3×(2/5)mol,同时由于从100mL溶液中取了20mL,故原溶液中草酸根离子的物质的量为(cV1-cV2)×10-3×5/2×5mol,故答案为:偏大;(cV1- cV2)×10-3×5/2×5mol。
考查方向
考查草酸亚铁的制备、除杂、净化等基本实验操作基础知识,以及考查根据草
酸亚铁受热分解变化过程中质量变化来确定反应过程,进一步考查了学生读图、识表等提取
信息以及加工信息的综合能力。
解题思路
(4)若省略步骤Ⅳ,则所得滤液中测定的草酸根离子含量Fe2+含量偏小,导致草酸根离子含量偏大;根据与草酸根离子反应的MnO4-量进行计算;
易错点
不能准确提取题给信息,特别是草酸亚铁加热分解图中有关数据信息不能转化为解题信息致错。
3.设NA为何伏加德罗常数的数值,下列说法不正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是( )
正确答案
解析
每小题有一个或两个正确选项,只有一个正确选项的,多选不给分,有两个正确选项的,选对一个给2分,选错一个该小题不给分。
知识点
12.已知A(g)+B(g)
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
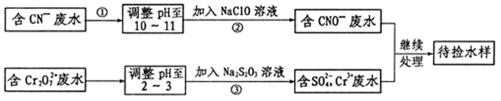
23.某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
请完成下列填空:
(1)HCN有剧毒,电子式是__________,其分子属于_____(填“极性”、“非极性”)分子。
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式。从中选择最详尽描述核外电子运动状态的方式,来表示氧原子的最外层电子的运动状态:_________________________,其中最外层有________种不同能量的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是______。
a.相同条件下水溶液的pH:NaClO>Na2S2O3
b.还原性:H2S>HCl
c.相同条件下水溶液的酸性:HClO3>H2SO3
d.稳定性:HCl>H2S
(4)写出流程③的离子方程式为:_______________________。
(5)反应③中,每消耗0.5 mol Cr2O72-转移的电子数为___________;
(6)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因__________________________。
正确答案
(1)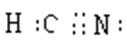
(2)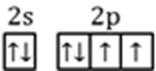
(3)bd;
(4)3S2O32-+4Cr2O72-+26H+→6SO42-+8Cr3++13H2O
(5)3.0NA(或1.806×1024)
(6)Cu2++2OH-→Cu(OH)2↓、Cu(OH)2(s)+S2-(aq) →CuS(s)+2OH-(aq)
或相同温度下,S(CuS)<S[Cu(OH)2],使沉淀的溶解平衡向更难溶的方向转化
解析
解析已在路上飞奔,马上就到!
知识点
8.下列反应中,属于取代反应的是( )
①CH3CH=CH2+Br2
②CH3CH2Br+NaOH
③CH3COOCH2CH3+H2O 
④C6H5OH+3H2
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列表述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析