- 质子数、中子数、核外电子数及其相互联系
- 共12题
3.设NA为何伏加德罗常数的数值,下列说法不正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.已知A(g)+B(g)
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
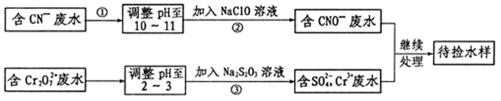
23.某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
请完成下列填空:
(1)HCN有剧毒,电子式是__________,其分子属于_____(填“极性”、“非极性”)分子。
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式。从中选择最详尽描述核外电子运动状态的方式,来表示氧原子的最外层电子的运动状态:_________________________,其中最外层有________种不同能量的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是______。
a.相同条件下水溶液的pH:NaClO>Na2S2O3
b.还原性:H2S>HCl
c.相同条件下水溶液的酸性:HClO3>H2SO3
d.稳定性:HCl>H2S
(4)写出流程③的离子方程式为:_______________________。
(5)反应③中,每消耗0.5 mol Cr2O72-转移的电子数为___________;
(6)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因__________________________。
正确答案
(1)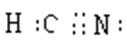
(2)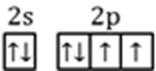
(3)bd;
(4)3S2O32-+4Cr2O72-+26H+→6SO42-+8Cr3++13H2O
(5)3.0NA(或1.806×1024)
(6)Cu2++2OH-→Cu(OH)2↓、Cu(OH)2(s)+S2-(aq) →CuS(s)+2OH-(aq)
或相同温度下,S(CuS)<S[Cu(OH)2],使沉淀的溶解平衡向更难溶的方向转化
解析
解析已在路上飞奔,马上就到!
知识点
7.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列表述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析