- 硅的用途
- 共21题
7.下列有关物质用途的说法错误的是
正确答案
解析
A.明矾净水的原理是铝离子水解生成的氢氧化铝胶体具有吸附作用,可以吸附水中悬浮物,具有净水作用,所以A正确;B.石灰吸收烟气中的二氧化硫,生成亚硫酸钙,继续氧化可以得到石膏,所以B正确;C.单质硅可用于制半导体、二氧化硅可用于制光导纤维;所以C错误;D.氯气与烧碱溶液反应产物有次氯酸钠,氯气和石灰乳反应产物有次氯酸钙,次氯酸钠和次氯酸钙都可以做消毒剂;所以D 正确;
考查方向
解题思路
A.明矾净水的原理是铝离子水解生成的氢氧化铝胶体具有吸附作用,可以吸附水中悬浮物,具有净水作用;B.石灰吸收烟气中的二氧化硫,生成亚硫酸钙,继续氧化可以得到石膏C.单质硅可用于制半导体、二氧化硅可用于制光导纤维;D.氯气与烧碱溶液反应产物有次氯酸钠,氯气和石灰乳反应产物有次氯酸钙,次氯酸钠和次氯酸钙都可以做消毒剂;
易错点
光导纤维的成分是二氧化硅而不是单质硅。
知识点
3.工业上通过反应“SiO2+2C
正确答案
解析
A.Si是亲氧元素,在自然界中以SiO2或硅酸盐的形式存在,故A错误;B.SiO2是制造光导纤维的材料,Si是制造硅芯片和硅太阳能电池的材料,故B错误;C.同一条件下,还原剂的还原性大于还原产物的还原性,该反应中C是还原剂、Si是还原产物,所以该反应条件下C的还原性比Si强,故C正确;D.温度和压强未知,无法计算CO物质的量,导致无法计算转移电子数,故D错误;
故选C
考查方向
解题思路
利用硅元素的物理性质和化学性质直接解题,计算仔细A.Si是亲氧元素,在自然界中以氧化物或硅酸盐的形式存在;B.SiO2是制造光导纤维的材料;C.同一条件下,还原剂的还原性大于还原产物的还原性;D.温度和压强未知,无法计算CO物质的量.
易错点
硅元素的物理性质和化学性质记忆不牢固
知识点
15.饱和二氧化硫水溶液中存在下列平衡体系:SO2+H2O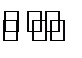
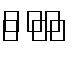
若向此溶液中( )
正确答案
解析
A.加水稀释平衡状态下微粒浓度减小,加水,SO32-浓度减小,故A错误;
B.氯气具有氧化性能氧化亚硫酸为硫酸,溶液中氢离子浓度增大,溶液PH减小,故B错误;
C.加入CaSO3粉末为不溶固体,在溶液中存在沉淀溶解平衡,亚硫酸根离子浓度增大,第二个平衡平衡逆向进行亚硫酸根离子浓度增大,故C错误;
D.通入HCl气体,氢离子浓度增大,第一步电离平衡逆向进行HSO3-离子浓度减小,故D正确;
考查方向
电离平衡与溶液的pH
解题思路
A.加水稀释平衡状态下微粒浓度减小;
B.氯气具有氧化性能氧化亚硫酸为硫酸,溶液中氢离子浓度增大;
C.加入CaSO3粉末为不溶固体,在溶液中存在沉淀溶解平衡,亚硫酸根离子浓度增大;
D.通入HCl气体,氢离子浓度增大,HSO3-离子浓度减小
易错点
弱电解质的电离平衡的影响分析
教师点评
本题考查了二氧化硫性质,弱电解质电离平衡的影响因素分析判断,掌握基础是解题关键,题目难度中等
知识点
5.用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无毒的气体,下列说法正确的是
正确答案
解析
除去含CN-,Cl- 废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无毒的气体,但由于在碱性条件,所以反应方程式为2CN-+5ClO-+2OH-═N2↑+2CO32-+5Cl-+H2O,
A.电解时,活泼金属作阳极,则阳极上金属失电子而不是电解质溶液中阴离子失电子,则电极材料不能用Fe作阳极,故A错误;
B.根据溶液pH、产物成分书写方程式为2CN-+5ClO-+2OH-═N2↑+2CO32-+5Cl-+H2O,故B正确;
C.阴极上是水得电子,电极反应式为2H2O+2e-═H2↑+2OH-,故C错误;
D.由以上反应可得到该装置排放出的气体主要为N2和H
考查方向
电解原理
解题思路
除去含CN-,Cl- 废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无毒的气体,但由于在碱性条件,所以反应方程式为2CN-+5ClO-+2OH-═N2↑+2CO32-+5Cl-+H2O,
A.电解时,活泼金属作阳极,则阳极上金属失电子而不是电解质溶液中阴离子失电子;
B.根据溶液pH、产物成分书写方程式;
C.阴极上是水得电子发生还原反应;
D.该装置排出的气体是氮气和氢气
易错点
阴极、阳极的电极反应式
教师点评
本题考查电解原理,为高频考点,侧重考查学生获取信息利用信息解答问题能力,正确判断电池反应式是解本题关键,难点是电极、电池反应式的书写,题目难度中等
知识点
3.下列颜色变化与氧化还原反应无关的是
正确答案
解析
A.将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色是由于K2Cr2O7与乙醇在硫酸的作用下生成了Cr2(SO4)3,Cr的化合价发生变化,所以A错;B.将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去是由于SO2和水反应生成H2SO3,H2SO3与NaOH发生中和反应消耗了NaOH,使溶液红色退去,但是所发生的化学反应的物质的化合价没有发生改变,所以B正确;C.将H2C2O4溶液滴入酸性KMnO4溶液中, 酸性KMnO4具有很强的氧化性,会将H2C2O4氧化为CO2,C元素的化合价发生改变,所以C错;D.将葡萄糖溶液加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀,红色沉淀是Cu2O,Cu(OH)2中Cu的化合价是+2价,Cu2O的Cu的化合价是+1价,反应前后物质的化合价发生改变,所以D错
考查方向
解题思路
本题只要判断出有化合价发生变化的则一定是发生了氧化还原反应。再用排除法,就可以确定答案
易错点
对4个选项中的物质的化合价的变化判断不清,不能清楚地判断出有无化合价发生变化。
知识点
扫码查看完整答案与解析
