- 电极反应和电池反应方程式
- 共352题
根据下图,下列判断正确的是
正确答案
解析
略
知识点
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)汽车尾气的大量排放是造成雾霾、酸雨、光化学烟雾的重要因素,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为_______外电路中电子从_______到_______(填“A”或“B”)移动。写出电池负极的电极反应方程式_______。
(2)工业废水中常含有一定量的Cr2O72-,它们会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3、Fe(OH)3沉淀。
①反应中,1mol的Cr2O72-生成沉淀,外电路通过电子的物质的量为_______mol。
②在阴极发生的电极反应方程式_______。
③常温下,Cr(OH)3的溶度积Ksp=10-32,溶液应调至pH=_______才能将废液排放。(Cr3+浓度小于10-5mol/L时,可认为完全除去)
(3)已知某温度下,H2CO3电离平衡常数Kl=8.5×10-7、K2=1.0×10-10。某碱性溶液中,经测定含有浓度较高的碳酸钠,向溶液中加入少量NaOH固体,[OH-]/[CO32-]_______(填“增大”“减小”或“不变”),该温度下,0.01mol/L的Na2CO3溶液中c(OH-)=_______mol·L -1(只考虑第一步水解,不要求精确计算)。
正确答案
(1) O2;A到B;CH3OH-6e-+H2O=CO2+6H+
(2) 12;2H++2e-=H2;5
(3) 增大;0.001
解析
略。
知识点
8.
I草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)草酸的电离方程式: 。
(2)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
(3) 常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程)。
Ⅱ甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来
合成甲醇:CO(g)+2H2(g)
(4)下列各项中,不能说明该反应已达到平衡的是 。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
(5)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
请分别画出在T1 、T2温度下,H2的浓度随时间变化的曲线
(6)已知甲醇燃料电池的工作原理如图所示。
该电池负极的电极反应式为: ,
正确答案
略
解析
略
知识点
硝酸铜在工业上常用作催化剂、氧化剂、荧光粉激活剂及光敏电阻材料等。工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
(1) 在步骤α中,可通入空气,其目的是
(2)在保温去铁的过程中,为使Fe3+ 沉淀完全,可以向溶液中加入 ,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
某同学提出用加水的方法直接调节溶液的pH,你觉得合理吗?简单说明理由。
(3)进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
(4)该粗铜可用电解原理精炼,电精炼时阳极的电极反应式是
(5)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3
正确答案
见解析。
解析
(1)提高原料的利用率,减少污染物的排放
(2) CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3 3.2~4.7 加水会将溶液稀释,在后期将滤液蒸发浓缩时会消耗更多能源,不利于生产
(3)由于Cu2+发生水解:Cu2++2H2O
(4)Cu - 2e-=Cu2+
(5)N2O4
知识点
4.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是( )
正确答案
解析
略
知识点
某化学小组用下图装置电解CuCl2溶液制少量漂白液:
(1)其阳极的反应式是:_________;导气管W端应与出气口_________连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:
化学小组分析提出:①红色物质可能有_________ 、或Cu2O、或二者都有;
②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:
取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,进行实验。
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是_________,无水硫酸铜的作用是 _________ ;
②d中反应的离子方程式是 _________;
③装置b中发生反应的化学方程式是_________ 。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为_________ 。
⑤阴极上产生白色物质的物质的量是 _________ ;若装置b冷却时不继续通H2,则计算所得Cu+的产率会_________(偏大、偏小、不变)。
正确答案
见解析。
解析
(1)2Cl- - 2e- = Cl2↑; X
(2)Cu
(3)①铜,检验红色物质中有无Cu2O;
②Ag++Cl- = AgCl↓
③2CuCl+H2=2Cu+2HCl
④Cu2+ + e- +Cl- = CuCl↓
⑤(W1-W2)/35.5 mol;偏小
知识点
X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期原子半径最大的元素,N是地壳中含量最高的金属元素。
用化学用语回答下列问题:
(1)M在元素周期表中的位置为_____________;六种元素的原子半径从大到小的顺序是_____________
(2)Z、X两元素按原子数目比l∶3构成分子A, A的电子式为_____________
Y、L两元素按原子数目比l∶2构成分子B,B中所含的化学键类型为_____________
(3)硒(se)是人体必需的微量元素,已知非金属性:34Se<L。请结合原子结构解释原因
(4)用Y、L、M构成的正盐溶液可以清除油污,请结合离子方程式以及必要的文字解释原因
(5)用石墨作电极,NCl3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出电解熔融Q制取N的电极方程式:
阳极:_____________;阴极:_____________。
正确答案
见解析。
解析
(1)第三周期、第ⅠA族;Na>Al>C>N>O>H
(2)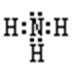
(3)O和Se同族,原子半径依次增大,导致得电子能力减弱,所以非金属性减弱。
(4) CO32- + H2O 
(5)2O2--4e-=O2↑,Al3+ +3e-=Al
知识点
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为_______、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为_______。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_______。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板,则a端应连接电源的_______极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有_______。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是_______,发生反应的离子方程式为_______,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会_______(填“偏高”或“偏低”)。
正确答案
(1)Cu2S、FeS(每空1分);2FeS+3O2
(2)2/3mol
(3)正;Fe-2e-=Fe2+;Cu-2e-=Cu2+
(4)酸性高锰酸钾有强氧化性,能腐蚀碱式滴定管上的橡皮管(或易使橡皮管老化),所以不能用碱式滴定管盛酸性高锰酸钾溶液(必须答出两个要点:一是氧化性;二是橡皮管);5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;偏低。
解析
略。
知识点
28.工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是_________。
A. n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
① a点正反应速率_________逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是_________,曲线Ⅱ对应的实验条件改变是_________ 。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:_________ 。
正确答案
见解析。
解析
(1) BC
(2) ① 大于;
② 升高温度 ;增大压强
③
④
(3)CH3OH+8OH--6e-=CO32-+ 6H2O
知识点
5.粗铜中一般含有锌、铁、银、金等杂质。在下图所示的装置中,甲池的总反应方程式为: 2CH3OH+3O2+4KOH==2K2CO3+6H2O 接通电路一段时间后,纯Cu电极质量增加了3.2 g。在此过程中,下列说法正确的是()
正确答案
解析
略
知识点
扫码查看完整答案与解析

















