- 电极反应和电池反应方程式
- 共352题
8.
I草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)草酸的电离方程式: 。
(2)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
(3) 常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程)。
Ⅱ甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来
合成甲醇:CO(g)+2H2(g)
(4)下列各项中,不能说明该反应已达到平衡的是 。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
(5)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
请分别画出在T1 、T2温度下,H2的浓度随时间变化的曲线
(6)已知甲醇燃料电池的工作原理如图所示。
该电池负极的电极反应式为: ,
正确答案
略
解析
略
知识点
某化学小组用下图装置电解CuCl2溶液制少量漂白液:
(1)其阳极的反应式是:_________;导气管W端应与出气口_________连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:
化学小组分析提出:①红色物质可能有_________ 、或Cu2O、或二者都有;
②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:
取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,进行实验。
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是_________,无水硫酸铜的作用是 _________ ;
②d中反应的离子方程式是 _________;
③装置b中发生反应的化学方程式是_________ 。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为_________ 。
⑤阴极上产生白色物质的物质的量是 _________ ;若装置b冷却时不继续通H2,则计算所得Cu+的产率会_________(偏大、偏小、不变)。
正确答案
见解析。
解析
(1)2Cl- - 2e- = Cl2↑; X
(2)Cu
(3)①铜,检验红色物质中有无Cu2O;
②Ag++Cl- = AgCl↓
③2CuCl+H2=2Cu+2HCl
④Cu2+ + e- +Cl- = CuCl↓
⑤(W1-W2)/35.5 mol;偏小
知识点
X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期原子半径最大的元素,N是地壳中含量最高的金属元素。
用化学用语回答下列问题:
(1)M在元素周期表中的位置为_____________;六种元素的原子半径从大到小的顺序是_____________
(2)Z、X两元素按原子数目比l∶3构成分子A, A的电子式为_____________
Y、L两元素按原子数目比l∶2构成分子B,B中所含的化学键类型为_____________
(3)硒(se)是人体必需的微量元素,已知非金属性:34Se<L。请结合原子结构解释原因
(4)用Y、L、M构成的正盐溶液可以清除油污,请结合离子方程式以及必要的文字解释原因
(5)用石墨作电极,NCl3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出电解熔融Q制取N的电极方程式:
阳极:_____________;阴极:_____________。
正确答案
见解析。
解析
(1)第三周期、第ⅠA族;Na>Al>C>N>O>H
(2)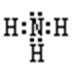
(3)O和Se同族,原子半径依次增大,导致得电子能力减弱,所以非金属性减弱。
(4) CO32- + H2O 
(5)2O2--4e-=O2↑,Al3+ +3e-=Al
知识点
28.工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是_________。
A. n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
① a点正反应速率_________逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是_________,曲线Ⅱ对应的实验条件改变是_________ 。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:_________ 。
正确答案
见解析。
解析
(1) BC
(2) ① 大于;
② 升高温度 ;增大压强
③
④
(3)CH3OH+8OH--6e-=CO32-+ 6H2O
知识点
5.粗铜中一般含有锌、铁、银、金等杂质。在下图所示的装置中,甲池的总反应方程式为: 2CH3OH+3O2+4KOH==2K2CO3+6H2O 接通电路一段时间后,纯Cu电极质量增加了3.2 g。在此过程中,下列说法正确的是()
正确答案
解析
略
知识点
扫码查看完整答案与解析











