- 电极反应和电池反应方程式
- 共352题
28.铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成份是



①取矿样10.Og加入过量稀盐酸溶解(假定其它未知成份的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250mL容量瓶中定容后,取25.OmL逐滴滴加
(l)写出滴加NaOH溶液24mL至30mL段发生反应的离子方程式_________。
(2)最后所得不溶于NaOH溶液的沉淀的化学式及其物质的量分别为:______
(3)该钒土矿样中
(4)工业上制取金属铝的化学原理可表示为:



正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.盐酸是重要的化工原料。工业上利用氢气与氯气反应制盐酸。回答下列问题
(1)氢气在氯气中燃烧的现象为( )。
(2)已知:
H2(g)的燃烧热为( ) 。断裂1 mol H—H键、Cl—Cl键需吸收的能量分别为436 kJ、242.8kJ,则断裂1 mol H—Cl键需吸收的能量为( )kJ。
(3)制取盐酸的原料氢气和氯气工业上通过氯碱工业制得。图是氯碱工业的原理示意图(阳离子交换膜只允许阳离子通过)。
①电解食盐水的化学方程式为( )
②图中,石墨接电源( ) 极,电解时铁电极的电极反应为 ( ),电解过程中通过离子交换膜的主要离子是( ) 。
(4)实验室利用二氧化锰跟浓盐酸反应制取氯气,反应的化学方程式是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.下列叙述正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. W、X、Y、Z四种短周期元素在元素周期表中的位置如下图所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物。请回答下列问题。
(1)W元素形成的同素异形体的晶体类型可能是(填序号)( )。①原子晶体②离子晶体③分子晶体④金属晶体
(2)H2Y2的电子式为( )。
(3)在下图中,b是含有Fe2+和淀粉KI的水溶液,且溶液的pH约为7,a为H2Y2的水溶液,打开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗1 mol Fe2+时,共转移3mol电子,该反应的离子方程式是( )。
(4)已知:298K时,金属钠与Y2气体反应,若生成l molNa2Y固体时,放出热量414 kJ;若生成1mol Na2Y2固体时,放出热量511 kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为( )。
(5)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入Z2的电极为原电池□的( )极,其电极反应式为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.汽车安全气囊在初次发生猛烈碰撞后的几十毫秒内迅速打开,可有效缓冲驾驶员和前排乘客所遭受的冲击力度,保护其头部不受伤害。汽车安全气囊中含有MYn和红棕色金属氧化物、SiO2等物质。M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,且可发生下图的转化关系。
(1)在2L密闭容器中投入2molY2和3.5molH2发生反应Ⅱ,测得YH3的物质的量在温度T1、 T2下随时间的变化如表所示:
① 已知该反应△H<0,则T1 T2 (填“>”、“<”或“=”);
②在温度T2下,达到平衡时YH3的平均速率v(YH3)= ( );平衡常数为( )(保留两位有效数字)。
③T2温度下达到平衡后,将容器的容积压缩到原来的1/2.在其他条件不变的情况下,对平衡体系产生的影响是 ( ) 。(填字母)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.YH3的物质的量增加 D.重新平衡时c(H2)/c(YH3)减小
(2) Y2H4是一种可燃性的液体,可用作火箭燃料。
①已知:N2(g)+2O2(g)==2NO2(g);△H= +67.7 kJ·mol-1
2N2H4(g)+2NO2(g) = 3N2(g) + 4H2O(g) △H=-1135.7 kJ·mol-1
计算反应:N2H4(g)+O2(g)==N2(g)+2H2O(g)△H=( ) kJ·mol-1
②水的电离方程式也可写为:H2O+H2O H3O++OH-,若液态Y2H4能够按照类似方式电离,请写出电离方程式:___________________________________。
③传统制备Y2H4的方法,是以MClO氧化YH3制得。反应Ⅲ的离子方程式是__________。
(3)Y2H4-空气燃料电池是一种高能电池,用20%-30%的KOH充当电解质溶液,则电池放电时的负极的电极反应式是 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.利用右图装置探究铁在海水中的电化学防护,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.电解原理应用于工业生产促进了经济的发展,其技术随时代发展不断更新、日臻完善。回答下列有关电解的问题。
(1)用阳离子膜电解槽(碳钢作阴极、钛网作阳极)电解饱和NaCl溶液;
①阳离子膜电解槽电解饱和NaCl溶液的核心技术是用阳离子膜将电解槽隔成阳极室和阴极室,其优点是:( );( )。
②检验阳极产生的气体的方法是( )。
③若阴极产生112mL气体(标准状况),所得溶液体积为100 mL,则溶液的pH为( ) 。
(2)用惰性电极电解100mL 1mol·L-1CuS04溶液:
①电解时阳极的电极反应式为( );
②电解一段时间后,在电解池的阳极上收集到224 mL气体(标准状况),若使电解质溶液恢复到100 mL 1mol·L-1CuS04溶液。则应向电解后的溶液中加入的一种物质名称为( ),其质量为( )g(忽略反应前后溶液的体积交化及气体溶于水的影响)。
正确答案
(1)①防止氢气、氯气混合爆炸;防止氯气与烧碱反应影响烧碱的纯度
② 将粘有润湿的碘化钾淀粉试纸的玻璃棒放到排气口,试纸变蓝(或用玻璃棒蘸氨水靠近排气口,产生白烟
③ 13
(2)① 4OH--4e-=O2↑+2H2O ②氧化铜 1.6 g
解析
解析已在路上飞奔,马上就到!
知识点
28.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
请回答下列问题:
(1)常温下,某氨水的pH =12,则水电离的c(OH—)=( )。若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度( )(填“大于”、“等于”或“小于”)氨水中水的电离程度。
(2)合成氨反应
(3)一定温度下,在密闭容器中可发生下列反应:

(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通人空气,另一电极通入NH3。其电池反应式为:4NH3+3O2=2N2 +6H2O。你认为电解质溶液应显( )(填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
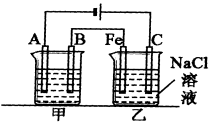
28.如下图所示:甲、乙为相互串联的两电解池。试回答:
(1)甲池若为电解精炼铜装置,则A电极名称为_____极,电极材料是________,电极反应式为_____________,电解质溶液可以是_________;
(2)乙池中Fe极电极反应式为__________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈________色;
(3)若甲池A极增重12.8 g,则乙池C(石墨)极放出气体在标况下的体积为______,电解后,若乙池剩余溶液为400 mL,则溶液的pH = ______。
正确答案
⑴阴极 精铜(或纯铜) Cu2+ + 2e – CuCuSO4溶液或CuCl2溶液
⑵2H+ + 2e – H2↑ 红
⑶4.48L 14
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析