- 电极反应和电池反应方程式
- 共352题
27.能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌。而甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 ( )。
(2)将1.0molCH4和2.0molH2O(g)通人容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图一。

图一 图二
①假设100℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为( );
②100℃时反应I的平衡常数为( ) 。
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是( )(填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时c(H2)/c(CH3OH)减小
E.平衡常数K增大
(4)工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图二所示。则当
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图三装置模拟上述过程:①写出阳极电极反应式 ( );②写出除去甲醇的离子方程式( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.根据右图,下列判断中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.下图两个装置中,分别装有200 mL对应的饱和溶液,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
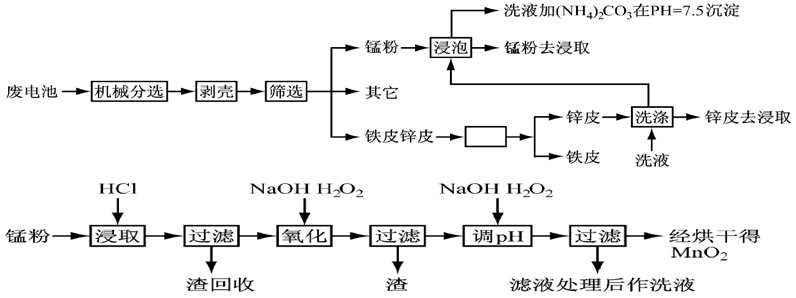
28.锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO2)进行湿法处理,通过预处理.浸取.净化等工序制出产品。工艺流程如下图:
查阅资料知各离子沉淀完全的pH为
已知:锌元素与铝元素相似,具有两性。
(1).市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为( );电极总反应方程为 ( );
(2).在预处理中,分离铁皮和锌皮的方法是( ),洗液加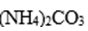
(3).二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式 ( );盐酸溶解后回收的渣是( );
(4).已知第二次加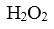
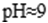
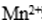
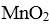
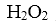
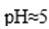
(5).实验室中用高锰酸钾溶液检验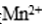
(6).硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为( )。
28.锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO2)进行湿法处理,通过预处理.浸取.净化等工序制出产品。工艺流程如下图:
查阅资料知各离子沉淀完全的pH为
已知:锌元素与铝元素相似,具有两性。
正确答案
1.市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为 ;
电极总反应方程为 ;
27.二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= ( )(小数点保留3位);若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将( )移动(填“向左”、 “向右”或“不”); 20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是( )(填序号);
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)利用







(4)肼(
(5)


正确答案
解析
知识点
扫码查看完整答案与解析