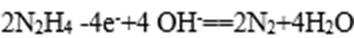- 电极反应和电池反应方程式
- 共352题
“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/Nicl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是
正确答案
解析
考察原电池原理。负极是液体金属Na,电极反应式为:Na-e-===Na+;正极是Ni,电极反应式为NiCl2+2e-=Ni+2Cl-;总反应是2Na+NiCl2=2NaCl+Ni。所以A、C、D正确,B错误。
知识点
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氧化钠辖液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为
(法拉第常数F=9.65×l04C · mol-1列式计算),最多能产生的氯气体积为 L(标准状况)。
正确答案
(1)
(2)H2
(3) 3.45×104C 4L
解析
(1)在碱性溶液中,甲烷燃料电池的总反应式为:


(2) b电极与通入甲烷的电极相连,作阴极,是H+放电,生成H2;电解氯化钠溶液的总反应方程式为:
(3)根据得失电子守恒,可得:1 mol CH4 ~8 mol e- ~4 mol Cl2,故若每个电池甲烷通入量为1 L(标准状况),生成4L Cl2;电解池通过的电量为

知识点
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
① 碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是_______(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的_______。
a.NH3 b. CO2 c. NaOH d. H NO3
② 以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为_______。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_______。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是_______。
(3)利用下图装置,可以模拟铁的电化学防护,若X为碳棒,为减缓铁的腐蚀,开关K应设置于_______处。若X为锌,开关K置于M处,该电化学防护法称为______。
正确答案
(1)①2Al+2OH-+4H2O=2Al(OH)4-+3H2↑;b。
②2Al+3H2O-6e-→Al2O3+6H+;废电解液中含有Al3+,和HCO3-发生了互促水解。
Al3+ +3HCO3-= Al(OH)3↓+3CO2↑
(2)阳极Cu可以发生氧化反应生成Cu2+。
(3)N; 牺牲阳极保护法。
解析
(1)①冒气泡的原因是Al与NaOH反应了,方程式为:2Al+2OH-+4H2O=2Al(OH)4-+3H2↑;
使Al(OH)4-生成沉淀,最好是通入CO2,加HNO3的话,沉淀容易溶解。[来源:学科网]
②阳极是Al发生氧化反应,要生成氧化膜还必须有H2O参加,故电极反应式为:2Al+3H2O-6e -
(2)电镀时,阳极Cu可以发生氧化反应生成Cu2+。
(3)铁被保护,可以是做原电池的负极,或者电解池的阴极,故若X为碳棒,开关K应置于N处,Fe做阴极受到保护;若X为锌,开关K置于M处,铁是做负极,称为牺牲阳极保护法。
知识点
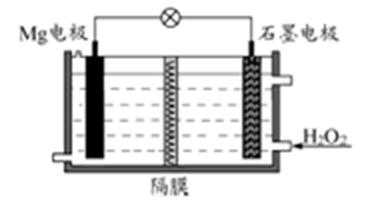
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是
正确答案
解析
略
知识点
下表列出了3种燃煤烟气脱硫方法的原理。
(1) 方法Ⅰ中氨水吸收燃煤烟气中
能提高燃煤烟气中
a增大氨水浓度 b升高反应温度
c使燃煤烟气与氨水充分接触 d通入空气使
采用方法Ⅰ脱硫,并不需要先出去燃煤烟气中大量的
(2) 方法Ⅱ重要发生了下列反应:







(3) 方法Ⅲ中用惰性电极电解
正确答案
(1)a c HCO3- +SO2= CO2+HSO3-
(2)S(g)+O2(g) = SO2 (g) ⊿H=-574.0kJ·mol-1
(3)O2、 SO2
解析
略
知识点
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
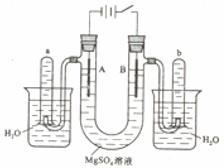
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2H4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2H4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
正确答案
(1)5
(2)2NH3+NaClO==N2H4+NaCl+H2O
(3)2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)
解析
(1)N原子的原子结构示意图为: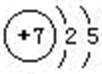
(2)NH3+NaClO——N2H4,根据元素守恒还应生成NaCl和H2O,观察法可配平方程式为 2NH3+NaClO==N2H4+NaCl+H2O;
(3)肼与N2O4反应生成N2和水蒸气:2N2H4 +N2O4==3N2+4H2O,观察已知的两个热方程式可知,②×2-①得:2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)“肼一空气燃料电池是一种碱性电池”中O2在正极反应,故负极是肼发生反应:
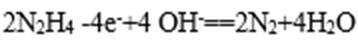
知识点
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:pb(s)+pbO2(s)+2H2SO4(aq)=2pbSO4(s)+2H2O(l)
电解池:2Al+3H2O
电解过程中,以下判断正确的是
正确答案
解析
该题考查原电池和电解池的基本知识。A选项H+离子在原电池中移向PbO2电极,错误。B选项每消耗3molPb,根据电子守恒生成lmolAl2O3,错误。C选项在原电池的正极电极反应是生成PbSO4,错误。D选项在原电池中Pb电极的质量由于生成PbSO4,质量增加,在电解池中,Pb阴极,质量不变,正确。
知识点
右图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,减色—黄色)。回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是 (填编号);
①A管溶液由红变黄; ②B管溶液由红变黄;
③A管溶液不变色; ④B管溶液不变色;
(2)写出A管中发生反应的反应式: ;
(3)写出B管中发生反应的反应式: ;
(4)检验a管中气体的方法是 ;
(5)检验b管中气体的方法是 ;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是 。
正确答案
(1)① ④
(2)2H++2e-=H2↑(写2H2O+2e-=2OH-+H2↑同样给分)
Mg2++2OH-=Mg(OH)2↓
(3)4OH--4e-=2H2O+O2↑(写2H2O-4e-=4H++O2↑同样给分)
(4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰
(5)用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸入试管内会复燃
(6)溶液呈红色,白色沉淀溶解(或大部分溶解)
解析
略
知识点
下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池。下列有关说法不正确的是( )
正确答案
解析
略
知识点
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
已知:3I2+6OH—==IO3—+5I—+3H2O
下列说法不正确的是
正确答案
解析
电解的电极反应为:阳极 2I——2e—== I2 左侧溶液变蓝色
3I2+6OH—==IO3—+5I—+3H2O 一段时间后,蓝色变浅
阴离子交换膜 向右侧移动
阴极 2H2O+2e—==H2↑+2OH— 右侧放出氢气
如果用阳离子交换膜代替阴离子交换膜:
电极反应为:阳极 2I——2e—== I2 多余K+
通过阳离子交换膜迁移至阴极
阴极 2H2O+2e—==H2↑+2OH— 保证两边溶液呈电中性
知识点
扫码查看完整答案与解析