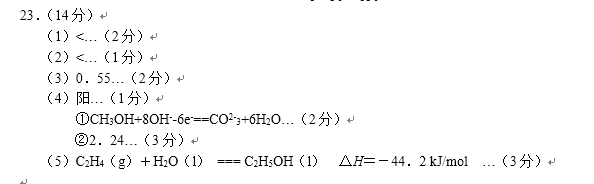- 电极反应和电池反应方程式
- 共352题
15. 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)=nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应

达到平衡时增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1KJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.“84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒。回答有关问题。
(1)“84”消毒液显碱性,原因是发生水解反应:ClO-+H2O
①该反应的平衡常数表达式K=( );25℃时某“84”消毒液pH为10,35℃时pH为11,则温度升高,K( )(填“增大”、“不变”或“减小”)。
②测定“84”消毒液的pH,应该选用( )。
A.干燥的pH试纸 B.用蒸馏水湿润的pH试纸 C.pH计(或酸度计)
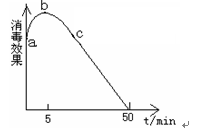
(2)在烧杯中盛放25mL某浓度的“84”消毒液,在光照下对其消毒效果的变化进行探究,实验结果如图所示。
①a-b段导致消毒效果增大的主要反应是:( ) 。
②b-c段导致消毒效果减弱的主要反应是:( )。
(3)有一则报道称:有人在清洗卫生间时,因为把“84”消毒液和某清洁剂(含盐酸)混合使用,发生了中毒事故。原因是( )。
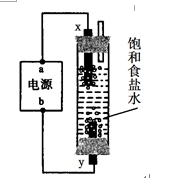
(4)利用图所示装置和试剂可以制得少量“84”消毒液。
①a电极的名称是( )。
②y电极的反应式为 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.
已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 
镍镉碱性充电电池在放电时,其
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用。镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用。回答下列问题:
⑴铅蓄电池在放电时的负极反应为( ),其在充电时阳极反应为( );
⑵镍镉碱性充电电池在充电时的总反应的化学方程式为( );
⑶上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的
主要原因可能是 ( );
⑷如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4( )mol。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.aA、bB、cC、dD、eE、fF、 gG七种短周期元素,原子序数依次增大。已知部分元素的原子序数有如下关系:b + c = f。人类巳知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、B两种元素;E、D、G组成的36电子的化合物N,是家用消毒剂的主要成分。请回答下列问题:
(1)消毒剂N的水溶液呈碱性,原因用离子方程式表示( )。
(2)元素E与D按原子个数比1:1形成的化合物M所含的化学键有( )(填化学键名称)。
(3)在A、B、D三种元素中选择两种或三种元素,组成两种可以发生反应的离子,写出该反应的离子方程式:( )
(4)已知在标准状况下,6g B单质完全燃烧和不完全燃烧分别放出Q1 和Q2 kJ 的热量,写出B单质与BO2反应的热化学方程式( )
(5)已知1 mol 化合物N与Na2SO3在溶液中发生反应时,转移2 mol电子,写出该反应的离子方程式( )
(6)常温下已知Ksp[F(OH)3]=1.3×10-33 ,若要使1.3mol·L-1 F3+ 离子开始生成F(OH)3沉淀, 应调节溶液的pH大于( )
(7)用惰性电极电解化合物FG3的水溶液,写出该电解池的总化学反应方程式:( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,
下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.2010年在上海举办的世博会将主打环保牌,20辆氢燃料电池公交车、300辆氢燃料电池出租车将投入运行,它们以氢气为能源,实现了真正的零污染。氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.结合右图判断,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.利用右图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
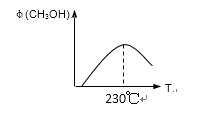
(1)合成甲醇的反应为:CO(g)+2H2(g)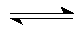
(2)若在230℃时,平衡常数K=1。若其它条件不变,
将温度升高到500℃时,达到平衡时,K ( ) 1 。
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的( )倍。
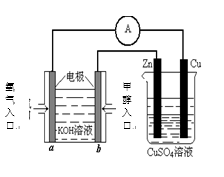
(4)利用甲醇燃料电池设计如右图所示的装置:
则该装置中Cu极为( )极;
①写出b极的电极反应式
②当铜片的质量变化为12.8 g时,a极上消耗的 O2
在标准状况下的体积为( ) L。
(5)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) == C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) == C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析