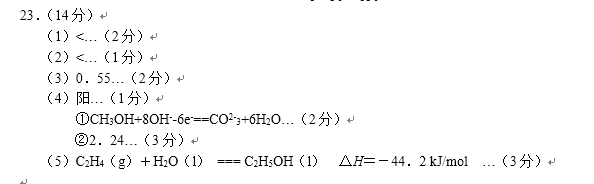- 电极反应和电池反应方程式
- 共352题
24.“84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒。回答有关问题。
(1)“84”消毒液显碱性,原因是发生水解反应:ClO-+H2O
①该反应的平衡常数表达式K=( );25℃时某“84”消毒液pH为10,35℃时pH为11,则温度升高,K( )(填“增大”、“不变”或“减小”)。
②测定“84”消毒液的pH,应该选用( )。
A.干燥的pH试纸 B.用蒸馏水湿润的pH试纸 C.pH计(或酸度计)
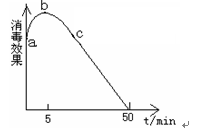
(2)在烧杯中盛放25mL某浓度的“84”消毒液,在光照下对其消毒效果的变化进行探究,实验结果如图所示。
①a-b段导致消毒效果增大的主要反应是:( ) 。
②b-c段导致消毒效果减弱的主要反应是:( )。
(3)有一则报道称:有人在清洗卫生间时,因为把“84”消毒液和某清洁剂(含盐酸)混合使用,发生了中毒事故。原因是( )。
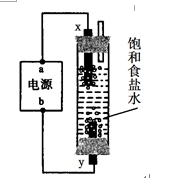
(4)利用图所示装置和试剂可以制得少量“84”消毒液。
①a电极的名称是( )。
②y电极的反应式为 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.aA、bB、cC、dD、eE、fF、 gG七种短周期元素,原子序数依次增大。已知部分元素的原子序数有如下关系:b + c = f。人类巳知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、B两种元素;E、D、G组成的36电子的化合物N,是家用消毒剂的主要成分。请回答下列问题:
(1)消毒剂N的水溶液呈碱性,原因用离子方程式表示( )。
(2)元素E与D按原子个数比1:1形成的化合物M所含的化学键有( )(填化学键名称)。
(3)在A、B、D三种元素中选择两种或三种元素,组成两种可以发生反应的离子,写出该反应的离子方程式:( )
(4)已知在标准状况下,6g B单质完全燃烧和不完全燃烧分别放出Q1 和Q2 kJ 的热量,写出B单质与BO2反应的热化学方程式( )
(5)已知1 mol 化合物N与Na2SO3在溶液中发生反应时,转移2 mol电子,写出该反应的离子方程式( )
(6)常温下已知Ksp[F(OH)3]=1.3×10-33 ,若要使1.3mol·L-1 F3+ 离子开始生成F(OH)3沉淀, 应调节溶液的pH大于( )
(7)用惰性电极电解化合物FG3的水溶液,写出该电解池的总化学反应方程式:( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,
下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.2010年在上海举办的世博会将主打环保牌,20辆氢燃料电池公交车、300辆氢燃料电池出租车将投入运行,它们以氢气为能源,实现了真正的零污染。氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
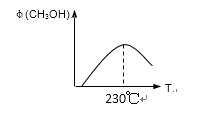
(1)合成甲醇的反应为:CO(g)+2H2(g)
(2)若在230℃时,平衡常数K=1。若其它条件不变,
将温度升高到500℃时,达到平衡时,K ( ) 1 。
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的( )倍。
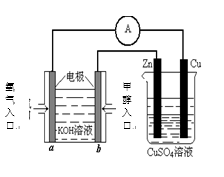
(4)利用甲醇燃料电池设计如右图所示的装置:
则该装置中Cu极为( )极;
①写出b极的电极反应式
②当铜片的质量变化为12.8 g时,a极上消耗的 O2
在标准状况下的体积为( ) L。
(5)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) == C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) == C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析