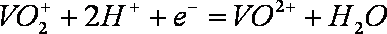- 电极反应和电池反应方程式
- 共352题
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为
②常温下,不能与M单质发生反应的是 (填序号)
a.CuSO4溶液
b.Fe2O3
c.浓硫酸
d.NaOH溶液
e.Na2CO3固体
(2)利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见右图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K= ;说明随温度的升高,曲线b向曲线a逼近的原因:
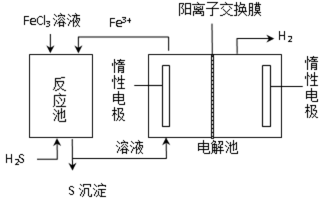
②电化学法
该法制氢过程的示意图如图。反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 。反应后的溶液进入电解池,电解总反应的离子方程式为 。
正确答案
见解析。
解析
(1)①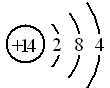
(2)①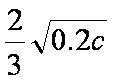
②增大反应物接触面积,使反应更反分
H2S + 2FeCl3 = 2FeCl2 + S↓ + 2HCl
知识点
一种充电电池放电时的电极反应为H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-
当为电池充电时,与外电源正极连接的电极上发生的反应是
正确答案
解析
由题中给出的电极反应可判断出做原电池时,H2是还原剂被氧化、NiO(OH)是氧化剂被还原,则充电时H2是还原产物、NiO(OH)是氧化产物,与正极相连的是阳极发生氧化反应,所以“NiO(OH)2的氧化”正确。
知识点
化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3—还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应离子方程式为 ,其平均反应速率v(NO3—)为 mol ∙L—1 ∙min—1
③还原过程中可生成中间产物NO2—,写出3种促进NO2—水解的方法 。
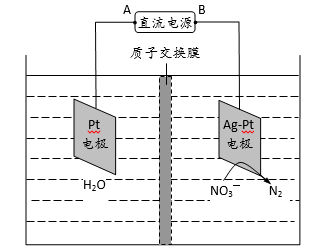
(2)电化学降解NO3—的原理如题图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
正确答案
(1)①N≡N
②
③加酸,升高温度,加水
(2)①A, 2NO3-+6H2O+10e-=N2+12OH-
②14.4
解析
(1)①N2分子中氮原子间通过氮氮三键结合,因此其结构式为N≡N;②利用溶液pH变化可知有OH-生成,再结合原子守恒可写出反应的离子方程式;利用离子方程式知v(NO3-)=v(OH-)=(10-2-10-7)/10=0.001mol/(L·min);③水解是吸热反应,NO2-水解使溶液中c(OH-)变大,因此可促进NO2-水解的措施有加热、加水或加酸等。
(2)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有OH-生成;②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g。
知识点
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
①一定条件下,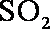

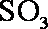
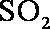
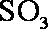
②工业制硫酸,尾气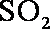
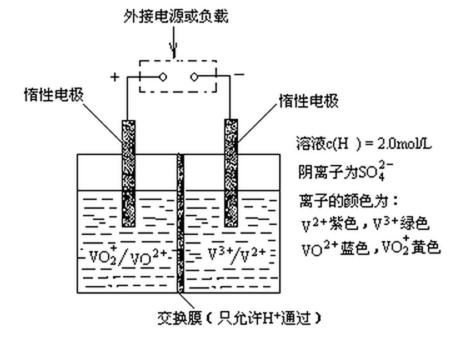
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
③放电过程中氢离子的作用是 和 ;充电时若转移的电子数为3.01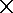
正确答案
(1)①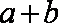
②氨水
(2)①
②绿 紫
③参与正极反应; 通过交换膜定向移动使电流通过溶液;0.5mol
解析
本题考查以钒为材料的化学原理题,涉及化学反应速率和电化学知识。
(1) 由S守恒可得,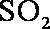
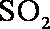
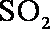
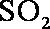
(2) ①左槽中,黄变蓝即为
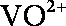
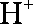
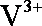
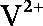
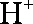
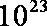
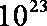
知识点
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为_______。要清洗附着在试管壁上的硫,可用的试剂是_______。
(2)下图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+
(3) Na2S溶液中离子浓度由大到小的顺序为_______,向该溶液中加入少量固体CuSO4,溶液pH_______(填“增大”“减小”或“不变”), Na2S溶液长期放置有硫析出,原因为_______(用离子方程式表示)。
正确答案
(1)2CH3CH2OH + 2Na
(2)xS+2e- = Sx2- ;离子导电(导电或电解质)和隔离钠与硫;4.5
(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);减小;2S2-+ 2H2O+O2=2S+ 4OH-
解析
(1)乙醇与钠反应的方程式为:2CH3CH2OH + 2Na
(2)正极上是S得到电子发生还原反应:xS+2e- = Sx2-;要形成闭合回路,M必须是能使离子在其中定向移动的,故M的两个作用是导电和隔膜;假设消耗的质量都是207 g,则铅蓄电池能提供的电子为2 mol,而钠硫电池提供的电子为
(3) Na2S溶液中,存在的水解反应为:H2O + S2- 

知识点
扫码查看完整答案与解析