- 电极反应和电池反应方程式
- 共352题
27.二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为( );
(4)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式( );
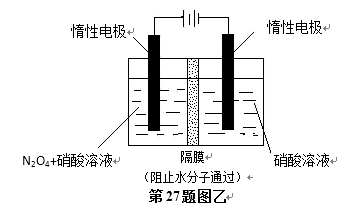
(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图乙所示,N2O5在电解池的 ( )(填“阳极”或“阴极”)区生成,其电极反应式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.(15分)运用化学反应原理分析解答以下问题
(1)已知:
① CO(g)+2H2(g)
② 2CH3OH(g)
③ CO(g)+H2O(g)
且三个反应的平衡常数依次为K1、 K2 K3
则反应 3CO(g)+3H2(g)
化学平衡常数K = ( ) (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1∶2的CO和.H2 气体通入体积一定的密闭容器中发生反应
3CO(g)+3H2(g)
a.体系压强保持不变 b.混合气体密度保持不变
c.CO和H2的物质的量保持不变 d.CO的消耗速率等于CO2的生成速率
(3)氨气溶于水得到氨水。在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为Mn02)生产髙锰酸钾分为两个步骤:
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2Mn04), 该反应的化学方程式是______________
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2Mn04)溶液,在_______ (填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2) 某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2Mn04.Mn02及Pb.Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
③轧钢废酸中Fe2+的作用是______________o
④操作I.操作Ⅱ.操作Ⅲ的名称是_______。
⑤溶液C中除含有Ca2+.Mn2+.H+外,还含有的阳离子是_______
⑥若固体C中不含CaCO3,则溶液D中
(已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.近日,卫生部公布了食盐碘含量的标准,规定每千克碘含量不超30毫克,新标准明年3月15日起实施。氯化钠既是是一种重要的生活必需品,也是重要的化工原料。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次 增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,另外三种是固体。
请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为( ),其分子属于( )(选填“极性”或“非极性”)分子。
D与C形成的化合物D2C2可与Y反应生成单质C,写出该反应的化学方程式并标明电子转移的方向和数目: ( ) 。
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出工业生产单质E的化 学反应方程式: ( ) 。
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8 g W气体(已知
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通人A的单质气体,N极通入C的单质气体,则M极的电极反应式为 ( ) 。
(5)在10 L的密闭容器中,通入2 mol的FC2气体和3 mol的C气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol/L,则平衡时FC2的转化率为 ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析