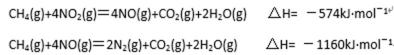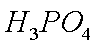- 电极反应和电池反应方程式
- 共352题
氢能是最重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁能源,其燃烧产物为 。
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO3,且反应前后B的化合价不变,该反应的化学方程式为,反应消耗1molNaBH4时转移的电子数目为。
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
在某温度下,向恒容容器中加入环已烷,其起始浓度为amol·L-1,平衡时苯的浓度为bmol·L-1,该反应的平衡常数K=
(4)一定条件下,题11图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
①导线中电子转移方向为 。(用A、D表示)
②生成目标产物的电极反应式为 。
③该储氢装置的电流效率η= 。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位。)
正确答案
解析
略
知识点
右图是一种航天器能量储存系统原理示意图。下列说法正确的是
正确答案
解析
略
知识点
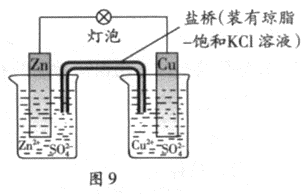
铜锌原电池(如图9)工作时,下列叙述正确的是
正确答案
解析
略
知识点
工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)
c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g)
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是__________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_______________________。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
则甲烷直接将NO2还原为N2的热化学方程式 为 。
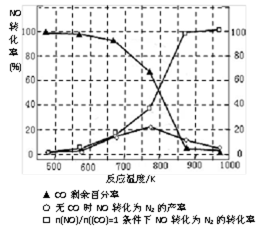
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如右图。据图分析,若不使用CO,温度超过775K发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在_______左右。
正确答案
(1)(2分)1 (2)(2分)<(写成“小于”扣1分)
(3)(4分)负极 (2分) 2NH3 — 6e- + 6OH- = N2 +6H2O (2分。化学式1分、配平1分)
(4)(3分)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-867kJ/mol (方程式2分,
△H数值1分)
(5)(5分)该反应是放热反应(1分),当在775K反应达到平衡后继续升高温度(1分),平衡向逆(左)方向移动,NO转化率降低(1分) 870K(2分。写860-875K之间任意数值均给分)
解析
略
知识点
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 ·
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为_ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为_ (填化学式)。
③NaH2PO2为_ (填“正盐”或“酸式盐”)}其溶液显 (填“弱酸性”.“中性”或“弱碱性”)。
(3)H3PO2的工业制法是,将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式
(4)也可用电渗析法制备,“四室电渗析法”工作原理如图所示〔阳膜和阴膜分别只允许阳离子,阴离子通过):
①写出阳极的电极反应式 。
②分析产品室可得到H3PO2原因_ ·
③早期采用“三室电渗析法”制备H3PO2:
将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有_ 杂质.该杂质产生的原因是
正确答案
(1)H3PO2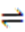
(2) ①+1
②
③正盐 弱碱性
(3)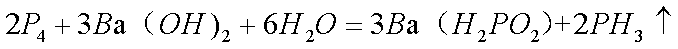
(4)①
②阳极室的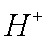
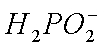

③
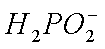
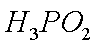
解析
略
知识点
扫码查看完整答案与解析