- 电极反应和电池反应方程式
- 共352题
运用所学知识,解决下列惩题:
(1)合成氨的热化学方程式为
已知:
(2)工业上用NH3和CO2原料合成尿素的化学方程式为:

①该反应的正反应是——反应(填“放热”或“吸热”)。
②在一定条件下,原料气中的氨碳比
③图中B处NH3的平衡转化率为____。
(3)氨可用作碱性燃料电池的燃料,电池反应为
(4)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图:
①电源的正极为____(填“A"或“B")。
②阳极室中发生的反应依次为____、____。
③邀鳃结束震,蘸极室溶液的pH与电解前相比将____(填“增大”、“减小”或“不变”);若两极挟收集到气体8。 96 1(标准状况),则除去的尿素为-g(忽略气体的溶解)。
正确答案
答案:(1)391(2分)
(2)①放热 (1分)②氨碳比增大,nNH3增大,尿素合成反应的平衡向正向移动,使CO2的转化率增大(2分) ③32%(2分)
(3)2NH3 - 6e- + 6OH- = N2+ 6H2O(2分)
(4)① A (1分) ②2Cl--2e- = Cl2 (1分) 3Cl2+CO(NH2)2+H2O = CO2+N2+6HCl(2分)③不变(1分) 4.8(2分)
解析
略
知识点
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)
①已知。25℃、101kPa时:




则反应

②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为_________mol,此反应的化学方程式是_________。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、

①电池放电时的总反应方程式为_________。
充电时,电极M应接电源的_________极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+)_________(填“增大”、“不变”或“减小”),阳极的电极反应式为_________。
正确答案
(1)①-197;减小;②4;2SO2+SeO2+2H2O=2H2SO4+Se
(2)①VO2++V2++2H+=VO2++V3++H2O;正极;②减小;VO2++H2O-e-=VO2++2H+
解析
略。
知识点
下图是一套电化学装置,对其有关说法错误的是
正确答案
解析
略
知识点
如何降低大气中CO2的含量及有效地开发利用CO2,已引起了全世界的普遍重视。“低碳经济”正成为科学家研究的主要课题。
(1)已知: ① CO(g)+H2O(g)
② C(s)+2H2(g)
③ 2CO(g)
写出CO2与H2反应生成CH4和H2O的热化学方程式 。
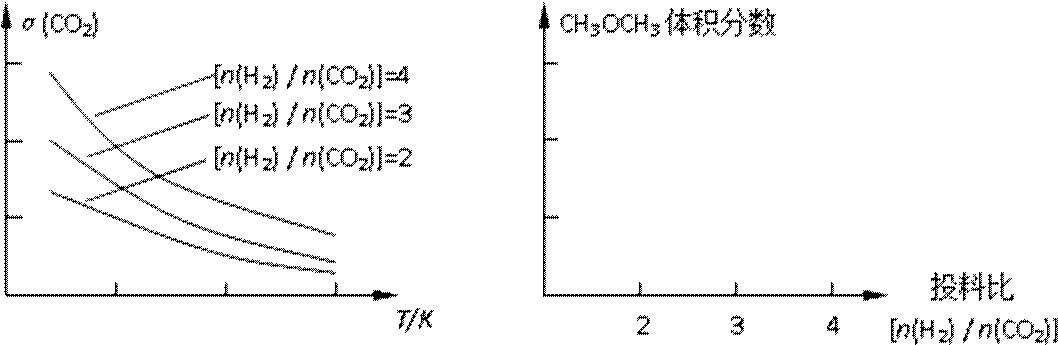
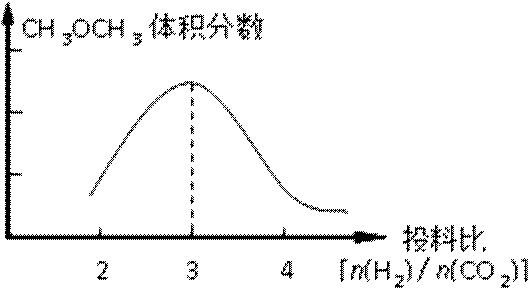
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在下图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
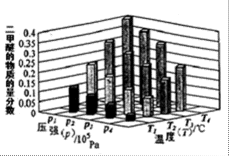
②某温度下,将2.0molCO2(g)和6.0mol(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是 ;
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
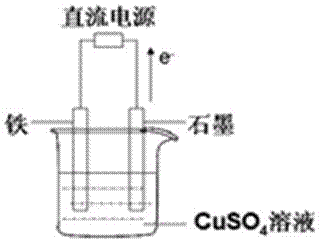
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式____ 。以此燃料电池作为外接电源按右图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 g。
正确答案
(1)CO2(g)+4H2(g) 
(2) ①画图
②BD (2分)
③ B (2分)
(3)CH3OH+H2O-6e-=CO2+6H+ (2分)
石墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅(2分),氧化铜(或碳酸铜)(2分),4g(或6.2g)(2分)
解析
略
知识点
Ⅰ,甲醇是一种新型的能源。
(1)合成气(组成为H2和CO)是生产甲醇的重要原料,请写出由焦炭和水在高温下制取合成气的化学方程式 。
(2)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为l L的密闭容器中,由CO和H2合成甲醇。在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是 (填序号)
A,温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH) =(mol·L-1·min-1)
B,该反应在T1时的平衡常数比T2时的大
C,该反应为吸热反应
D,处于A点的反应体系从T1变到T2,达到平衡时减小
(4)在T1温度时,将1 mol CO和2mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO转化率为a,则容器内的压强与起始压强之比为 ;
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,负极的反应式为 ;假设原电解质为NaOH,且电池工作一段时间后溶质只有Na2CO3,此时溶液中各离子浓度大小关系为
Ⅱ,已知Ksp(AgCl)=1.56×10-10 ,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有C1-, Br-和CrO42-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 。
正确答案
答案:
Ⅰ(1)C+H2O
(2)CH3OH(l)+O2(g)= CO(g)+2H2O(l)H=-443.5kJ·mol-1
(3)AB
(4)1-
(5)CH3OH-6e-+8OH-=== CO32-+6H2O c(Na+)> c(CO32-)> c(OH-)>c(HCO3-)> c(H+)
Ⅱ Br-、C1-、CrO42-
解析
略
知识点
一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH2OH和O2,下解说法不正确的是
正确答案
解析
略
知识点
化合物甲由不同周期的短周期元素X、Y组成,是良好的耐热冲击材料。
X原子的最外层电子数比次外层电子数少5, Y元素是空气中含量最高的元素。
(1)X的原子结构示意图是 ,甲的化学式是
(2)X的硫酸盐溶液与过量
(3) 1mol X单质与Fe2O3反应,放出414.21 KJ热量,该反应的热化学反应方程式是 。
(4)利用以X为阳极,在H2SO4 溶液中电解的方法,可在X表面形成X的氧化物,此方法可用于工业制备氧化膜,写出阳极电极反应式 。
(5)一定条件下,甲和水缓慢作用生成含Y的化合物乙,乙分子含有10个电子。乙在微生物作用下可与O2发生反应,当有1 mol 乙参加反应时,电子转移6 mol,该反应的化学方程式是 。
正确答案
见解析。
解析
(1)
(2)Al3++4OH-===AlO2-+2H2O
(3)2Al(s) + Fe2O3(s) === Al2O3(s) +2Fe(s) △H = -828.42 kJ/mol
(4)2Al+3H2O-6e-= Al2O3+ 6H+
(5)
知识点
生物燃料电池是以有机物为燃料,直接或简介利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率 高,是一种真正意义上的绿色电池。其工作原理如图所示。下列有关说法正确的是
正确答案
解析
略
知识点
H2O2是一种强氧化剂,被广泛应用于水处理及卫生消毒等方面。
(1)H2O2不稳定,当其中含Fe2+时,会发生反应:
(2)下表是在常压、60℃和不同pH条件下,6mL30%在60minH2O2内释放出氧气的体积。则下列说法正确的是__________。
a. pH越大,H2O2的分解速率越大
b. pH在9左右,H2O2的分解速率最大
c. 6mL30%分解最多释放出的氧气的体积为639mL
d. pH=5.50时,0~60min内,v=1.5mL
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-被还原为Mn2+,该反应的离子方程式为__________。
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2。电解过程中,阳极区溶液的pH_(填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为__________。若不通空气,则阴极得到的产物是__________。
(5)己知断裂1mol化学键所需的能量

正确答案
(1)催化作用(或催化剂); 0.03
(2)bd
(3)5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
(4)减小;O2+2H++2e-=H2O2;H2
(5)-135
解析
略。
知识点
结合右图判断,下列叙述正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析