- 电极反应和电池反应方程式
- 共352题
运用所学知识,解决下列惩题:
(1)合成氨的热化学方程式为
已知:
(2)工业上用NH3和CO2原料合成尿素的化学方程式为:

①该反应的正反应是——反应(填“放热”或“吸热”)。
②在一定条件下,原料气中的氨碳比
③图中B处NH3的平衡转化率为____。
(3)氨可用作碱性燃料电池的燃料,电池反应为
(4)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图:
①电源的正极为____(填“A"或“B")。
②阳极室中发生的反应依次为____、____。
③邀鳃结束震,蘸极室溶液的pH与电解前相比将____(填“增大”、“减小”或“不变”);若两极挟收集到气体8。 96 1(标准状况),则除去的尿素为-g(忽略气体的溶解)。
正确答案
答案:(1)391(2分)
(2)①放热 (1分)②氨碳比增大,nNH3增大,尿素合成反应的平衡向正向移动,使CO2的转化率增大(2分) ③32%(2分)
(3)2NH3 - 6e- + 6OH- = N2+ 6H2O(2分)
(4)① A (1分) ②2Cl--2e- = Cl2 (1分) 3Cl2+CO(NH2)2+H2O = CO2+N2+6HCl(2分)③不变(1分) 4.8(2分)
解析
略
知识点
如何降低大气中CO2的含量及有效地开发利用CO2,已引起了全世界的普遍重视。“低碳经济”正成为科学家研究的主要课题。
(1)已知: ① CO(g)+H2O(g)
② C(s)+2H2(g)
③ 2CO(g)
写出CO2与H2反应生成CH4和H2O的热化学方程式 。
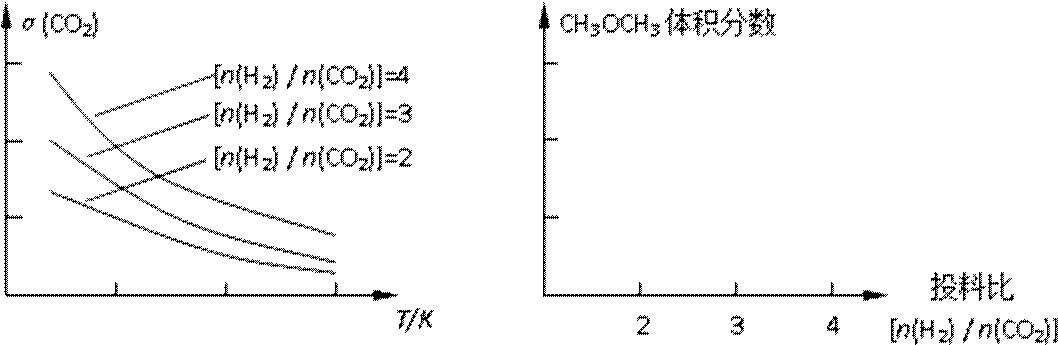
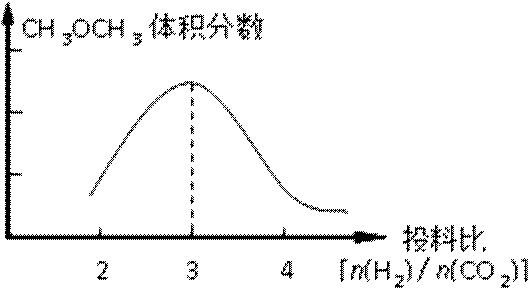
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在下图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
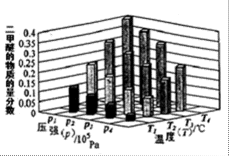
②某温度下,将2.0molCO2(g)和6.0mol(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是 ;
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
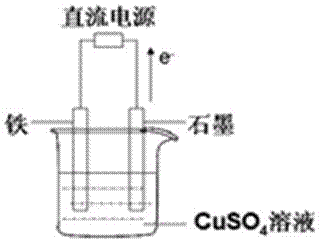
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式____ 。以此燃料电池作为外接电源按右图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 g。
正确答案
(1)CO2(g)+4H2(g) 
(2) ①画图
②BD (2分)
③ B (2分)
(3)CH3OH+H2O-6e-=CO2+6H+ (2分)
石墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅(2分),氧化铜(或碳酸铜)(2分),4g(或6.2g)(2分)
解析
略
知识点
一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH2OH和O2,下解说法不正确的是
正确答案
解析
略
知识点
H2O2是一种强氧化剂,被广泛应用于水处理及卫生消毒等方面。
(1)H2O2不稳定,当其中含Fe2+时,会发生反应:
(2)下表是在常压、60℃和不同pH条件下,6mL30%在60minH2O2内释放出氧气的体积。则下列说法正确的是__________。
a. pH越大,H2O2的分解速率越大
b. pH在9左右,H2O2的分解速率最大
c. 6mL30%分解最多释放出的氧气的体积为639mL
d. pH=5.50时,0~60min内,v=1.5mL
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-被还原为Mn2+,该反应的离子方程式为__________。
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2。电解过程中,阳极区溶液的pH_(填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为__________。若不通空气,则阴极得到的产物是__________。
(5)己知断裂1mol化学键所需的能量

正确答案
(1)催化作用(或催化剂); 0.03
(2)bd
(3)5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
(4)减小;O2+2H++2e-=H2O2;H2
(5)-135
解析
略。
知识点
结合右图判断,下列叙述正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析